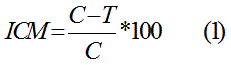
ARTÍCULO DE INVESTIGACIÓN
Actividad antifúngica in vitro de extractos de hojas de Citrus spp. frente a Stemphyllium solani Weber
In vitro antifungal activity of Citrus spp. leaves extracts against Stemphyllium solani Weber
Dianella Iglesias1, Katia Ojito-Ramos1, Claudia Linares Rivero2 y Orelvis Portal1
1Departamento de Biología, Facultad de Ciencias Agropecuarias, Universidad Central "Marta Abreu" de Las Villas, Carretera a Camajuaní km 5 ½, Santa Clara, Cuba. CP 54830
2Centro de Bioplantas, Universidad de Ciego de Ávila "Máximo Gómez Báez", Carretera a Morón km 9 ½, Ciego de Ávila, Cuba. CP 069450
E-mails: diglesias@uclv.cu; kojito@uclv.edu.cu; orelvispv@uclv.cu; claudia@bioplantas.cu
RESUMEN
El tomate es una hortaliza de elevada aceptación en el mundo, la cual es afectada por varios patógenos entre los que se encuentra Stemphyllium solani Weber, causante de la mancha gris. El control de esta enfermedad se basa en la aplicación de fungicidas químicos, los cuales aumentan los costos de producción y provocan contaminación al ambiente, por lo cual se hace necesaria la búsqueda de métodos de control agroecológicos, como es el uso de extractos de plantas. El objetivo de este trabajo fue determinar la actividad antifúngica "in vitro" de extractos de hojas de Citrus spp. frente a S. solani. Los extractos se obtuvieron mediante extracción asistida por ultrasonido y se cuantificó el contenido de fenoles totales. Para cada extracto se estableció la concentración inhibitoria mínima, se determinó el porcentaje de inhibición del crecimiento micelial y de la germinación de los conidios. En todos los extractos se obtuvieron concentraciones de fenoles totales superiores a 36 mg equivalentes a ácido gálico mL-1 de extracto. El extracto etanólico de Citrus aurantium var. sinensis (L.) Osbeck mostró la menor concentración inhibitoria mínima. Los extractos evaluados, excepto el de Citrus aurantium L. en etanol, mostraron porcentajes de inhibición del crecimiento micelial del 100 %. Sin embargo, solamente los extractos de C. aurantium var. sinensis en etanol y el de Citrus reticulata Blanco en metanol mostraron porcentajes de inhibición de la germinación de los conidios de 100 %, por lo que fueron seleccionados como los más efectivos en el control "in vitro" de S. solani.
Palabras clave: control agroecológico, fenoles, mancha gris, tomate
ABSTRACT
Tomato is a horticultural crop with high acceptance worldwide, which is affected for several pathogens in those who find Stemphyllium solani Weber, responsible for the gray leaf spot. The control of this disease is based on application of chemical fungicides, which increase production costs and cause pollution to the environment, so the search for methods of agroecological control is necessary, as is the use of plant extracts. The aim of this work was to determine the "in vitro" antifungal activity of Critus spp. extracts against S. solani. The extracts were obtained by ultrasonic assisted extraction and then the total phenols content was quantified. For each extract was established the minimal inhibitory concentration, and then was determined the percentage of inhibition of micelial growth and the percentage of inhibition of conidial germination. In all extracts were obtained concentrations of totals phenols highest than 36 mg equivalent to galic acid mL-1 of extracts. The ethanolic extract of Citrus aurantium var. sinensis (L.) Osbeck showed the lowest minimum inhibitory concentration against S. solani. The tested extracts, except C. aurantium L. in ethanol, showed percentages of inhibition of mycelial growth of S. solani of 100 %. However, only the extracts of C. aurantium var. sinensis in ethanol and Citrus reticulata Blanco in methanol showed percentages of inhibition of conidial germination of 100 %, so they were selected as the most effective in the in vitro control of S. solani.
Keywords: agroecologycal control, phenols, gray leaf spot, tomato
INTRODUCCIÓN
Solanum lycopersicum L. (tomate) es una de las hortalizas más cultivadas y difundidas en el mundo, debido a sus cualidades gustativas y su aporte nutricional basado en un alto contenido de minerales y vitaminas (Luna-Guevara y Delgado-Alvarado, 2014). Una de las estrategias para extender el calendario de cosecha del tomate es el empleo de los sistemas de cultivo protegido. Sin embargo, en estos sistemas de producción existen condiciones climáticas y agronómicas favorables para el desarrollo de enfermedades provocadas por hongos, entre las cuales se encuentra la mancha gris o quema foliar causada por Stemphyllium solani Weber (Cedeño et al., 2011).
El control fitosanitario de esta enfermedad se realiza principalmente mediante el uso de fungicidas sintéticos (Khalil et al., 2005). No obstante, estos fungicidas incrementan los costos de producción y causan perjuicios al ambiente y al hombre (Amini et al., 2012), por lo que resulta necesario la búsqueda de alternativas menos costosas y más saludables, pero efectivas, para el manejo de esta enfermedad.
Los extractos de plantas constituyen una fuente de productos naturales con actividad antifúngica demostrada y son de menor costo económico (Centurión et al., 2013). Con frecuencia, estos biopreparados se obtienen a partir de plantas del género Citrus L., debido a que poseen altas concentraciones de metabolitos con actividad antimicrobiana, entre los cuales se destacan los compuestos fenólicos (Irkin et al., 2015). En la mayor parte de los estudios que emplean extractos obtenidos de Citrus spp. se han utilizado los frutos de estas plantas, sin embargo, las hojas constituyen una abundante fuente de compuestos fenólicos (Ojito et al., 2012). El objetivo de este trabajo fue determinar la actividad antifúngica "in vitro" de extractos de hojas de Citrus spp. frente a S. solani.
MATERIALES Y MÉTODOS
Obtención de extractos de hojas de Citrus spp.
La colecta de hojas de Citrus aurantium var. sinensis (L.) Osbeck, Citrus aurantium L., Citrus aurantiifolia (Christm.) Swingle, Citrus reticulata Blanco y Citrus latifolia Tanaka ex Q. Jiménez se realizó según el método descrito por Ojito et al. (2012). El material colectado se lavó con agua destilada estéril y se secó en una estufa (Haubelt Laborgeräte GmbH, Alemania) a 60 °C durante 72 h. Posteriormente, se trituró en un molino de cinco pulgadas (Chrisly y Norris, Reino Unido)
A 2 g de hojas pulverizadas se le adicionaron 20 mL de metanol 70 % (UniChem, China) o etanol 70 % (UniChem, China), según correspondiese. Posteriormente, se sometieron a baño ultrasónico (Branson Ultrasonic Corporation, EE. UU.) durante 20 min a una temperatura de 27 °C. Los extractos se filtraron en bomba de vacío (Liuyi, China). Se cuantificó el contenido de fenoles totales de los extractos según el método descrito por Silva-Espinoza et al. (2013). La concentración de fenoles totales se determinó mediante extrapolación en una curva de calibración con ácido gálico (Sigma-Aldrich, Alemania) como patrón y se expresó en mg de equivalentes a ácido gálico mL-1 de extracto (mg EAG mL-1).
Concentración Inhibitoria Mínima
El aislado de S. solani se obtuvo del Laboratorio de Microbiología Agrícola de la Facultad de Ciencias Agropecuarias, perteneciente a la Universidad Central "Marta Abreu" de Las Villas, obtenido a partir de plantas de tomate con síntomas de la mancha gris. El hongo fue inoculado a placa de Petri de 90 mm de diámetro con medio de cultivo Agar Papa Dextrosa (PDA, Merck, Alemania) durante siete días a 27 ± 1 °C en oscuridad total (incubadora Mermmert, Alemania). Discos de 0,6 cm de diámetro de micelio de S. solani se trasfirieron a medio de cultivo Caldo Papa Dextrosa (PDB; Difco, Alemania) y se dejaron crecer en un Erlenmeyer en constante movimiento en una zaranda (Gerhardt, Alemania) durante 72 h, a 120 rpm y 27 ± 1 °C. Posteriormente, 1 g de S. solani se trituró en un homogenizador Ultra-Turrax T25 (Rose Scientific Ltd., Canadá) y se ajustó la concentración a 5 x 105 fragmentos de micelios mL-1 en una cámara de Neubauer (Brand, Alemania).
La concentración inhibitoria mínima (CIM) se determinó en función de la concentración de fenoles totales del extracto por el método de microdilución (Eloff, 1998). La concentración de fenoles totales de todos los extractos se ajustó a 80 mg EAG mL-1 mediante dilución en agua destilada estéril. En microplacas de 96 pocillos (Thermo Scientific, EE. UU.) se realizaron diluciones seriadas de los extractos a partir de la concentración de 80 mg EAG mL-1 hasta 0,0195 mg EAG mL-1 de fenoles totales en 100 µL de medio de cultivo PDB. Como control de actividad antifúngica se empleó el fungicida Tebuconazol 1 mg mL-1 (Orius 25 EW; Milenia Agro Ciencias S.A., Brasil) (Saha et al., 2014) en medio de cultivo PDB. Como control de crecimiento del hongo se empleó el medio de cultivo PDB y medio de cultivo PDB con el disolvente de extracción diluido en agua destilada estéril a la misma proporción en que se prepararon los extractos. Posteriormente, a cada pocillo se agregó la suspensión de 5 x 105 fragmentos de micelios mL-1 de S. solani. Las microplacas permanecieron en incubadora (Mermmert, Alemania) durante siete días en cámara húmeda a 27 ± 1 °C, en oscuridad. Para cada extracto y controles se realizaron tres réplicas, y el ensayo completo se realizó tres veces.
El crecimiento micelial se observó en un estereoscopio (Novel, China) a partir de 72 h de incubación, cada 24 h por siete días. La CIM se definió como la menor concentración del extracto a la cual no se observó crecimiento de S. solani.
Inhibición del crecimiento micelial
Se determinó el efecto de los extractos que se consideraron promisorios según la CIM, en el crecimiento radial de S. solani. Para cada extracto y controles se realizaron tres réplicas y el ensayo completo se realizó tres veces.
Discos de micelio de 0,6 cm de diámetro de S. solani fueron colocados en el centro de placas de Petri de 90 mm de diámetro que contenían medio de cultivo PDA con el extracto a una concentración de fenoles totales según los resultados de la CIM. Las placas permanecieron en incubadora (Mermmert, Alemania) durante siete días en oscuridad a una temperatura de 27 ± 1 °C. Luego de las 72 h de incubación, se midió el diámetro del micelio cada 24 h durante siete días. El porcentaje de inhibición del crecimiento micelial se calculó utilizando la siguiente fórmula:
donde,
ICM - porcentaje de inhibición del crecimiento micelial
C - diámetro de la colonia de S. solani (cm) crecida en medio de cultivo PDA con el disolvente diluido a la misma proporción en que se prepararon los extractos
T - diámetro de la colonia de S. solani (cm) crecida en medio de cultivo PDA con los extractos o el fungicida
En este ensayo se utilizó como control de actividad antifúngica el fungicida Tebuconazol 1 mg mL-1en el medio de cultivo PDA. En el control del crecimiento del hongo se empleó el medio de cultivo PDA y el medio de cultivo PDA con el disolvente de extracción diluido en agua destilada estéril a la misma proporción en que se prepararon los extractos.
Inhibición de la germinación de los conidios
La inhibición de la germinación de los conidios se determinó mediante la técnica de la gota colgante (Kavitha et al., 2005). Solo se evaluaron los extractos que se consideraron promisorios según el porcentaje de inhibición del crecimiento micelial obtenido en el ensayo anterior. Para cada extracto y controles se realizaron tres réplicas y el ensayo completo se realizó dos veces.
En 5 mL de agua destilada estéril o de extractos de plantas a una concentración de fenoles totales, según los resultados de la CIM, se agitó en un vortex MS 3 (IKA®, Alemania) un disco de micelio de S. Solani de 0,6 cm de diámetro con el fin de lograr una abundante dispersión de los conidios contenidos en el micelio. Posteriormente, se ajustó la concentración a 5 x 105 conidios mL-1 en una cámara de Neubauer (Brand, Alemania). A portaobjetos excavados se les aplicó 20 µL de la suspensión conidial de S. solani sometida a los diferentes extractos y controles. Los portaobjetos fueron colocados en cámaras húmedas y posteriormente en la incubadora (Mermmert, Alemania) a 27 ± 1 °C durante 24 h y en oscuridad total.
Se evaluaron al microscopio óptico (Leitz Wetzlar, Alemania) tres campos por cada gota, contándose al azar 100 conidios y se determinó el número de conidios germinados (cuando el tubo germinativo fue igual o superior en longitud al conidio). El porcentaje de inhibición de la germinación de los conidios se calculó empleando la siguiente fórmula:
donde,
IGC - porcentaje de inhibición de la germinación de los conidios
C - número de conidios de S. solani germinados en agua destilada estéril con el disolvente diluido a la misma proporción en que se prepararon los extractos
T - número de conidios de S. solani germinados en los extractos o el fungicida
Se consideraron promisorios los extractos que mostraron valores de inhibición superiores al 50 % (Bahraminejad et al., 2015).
En este ensayo se utilizó como control de actividad antifúngica el fungicida Tebuconazol 1 mg mL-1. Como control de la germinación de los conidios se empleó agua destilada estéril y el disolvente de extracción diluido en agua destilada estéril a la misma proporción en que prepararon los extractos.
Procesamiento estadístico
Los datos fueron analizados con el paquete estadístico PASW Statistics, versión 18, para Windows verificándose los supuestos de normalidad Sapiro Wilk. Los datos que no seguían distribución normal se procesaron mediante análisis de varianza para dos variables no relacionadas, U de Mann Whitney, y varias muestras independientes, Kruskal Wallis. En todos los casos las diferencias se consideraron significativas para un valor de p<0,05.
RESULTADOS Y DISCUSIÓN
Obtención de extractos de hojas de Citrus spp.
A partir de cada una de las especies de Citrus se obtuvieron dos extractos; uno en etanol y otro en metanol. En todos los extractos se obtuvieron concentraciones de fenoles totales superiores a los 36 mg EAG mL-1 de extracto (Tabla 1). Los extractos que mostraron mayor concentración de fenoles totales fueron el de C. aurantium en etanol y metanol, mientras que el de C. aurantiifolia en etanol mostró la menor concentración.
La determinación del contenido de fenoles totales se ha realizado en algunos representantes del género Citrus, mayormente a extractos obtenidos a partir del jugo y la corteza, así como de aceites esenciales de los frutos (Madhuri et al., 2014). En este sentido, en extractos etanólicos de C. aurantiumy en extractos acuosos de corteza de C. aurantium var. sinensis se han obtenido concentraciones de fenoles de 4,55 mg EAG g-1 (Karimi et al., 2012) y de 9,40 mg EAG g-1 (Omoba et al., 2015) respectivamente. Debido al empleo de unidades de medida diferente al expresar los resultados en la determinación del contenido de fenoles totales, la comparación entre estos se dificulta. Si se tiene en cuenta que los extractos de C. aurantium var. sinensisy C. aurantium evaluados en este trabajo, se obtuvieron a una concentración de 0,1 g de hojas pulverizadas por mL de disolvente de extracción y el resultado se expresó en mg EAG mL-1 de extracto, la concentración de fenoles totales obtenida en estos extractos (Tabla 1) fue superior con respecto a las referidas por Karimi et al. (2012) y Omoba et al. (2015). Esto pudo deberse a que la concentración de fenoles presenta variaciones en los diferentes órganos de las plantas, siendo mayor en las hojas (Romeo et al., 2015).
Concentración Inhibitoria Mínima
Los extractos de C. aurantium y C. latifolia en los dos disolventes de extracción y el de C. aurantiifolia en etanol no mostraron actividad antifúngica frente a S. solani a las concentraciones evaluadas (Tabla 2). El extracto que mostró la menor CIM fue el de C. aurantium var. sinensis en etanol, similar a la del fungicida empleado como control.
La determinación de la CIM por microdilución se empleó como primer criterio de selección de los extractos de hojas de Citrus spp. con actividad antifúngica frente a S. solani y con el objetivo de determinar la concentración de fenoles totales a la cual la mayoría de los extractos mostraban esta actividad biológica. Aunque la CIM se ha generalizado para la determinación de la concentración a aplicar de extractos de plantas frente a un microorganismo (Castillo-Reyes et al., 2015), de acuerdo a la literatura consultada, es la primera vez donde se determina frente a S. solani.
Inhibición del crecimiento micelial
Los extractos evaluados, con excepción del extracto C. aurantiifolia en etanol, presentaron porcentajes de inhibición del crecimiento micelial de S. solani de 100 %. Este resultado fue similar al obtenido cuando se empleó el fungicida sintético Tebuconazol (Figura 1). El hecho de que el extracto de C. aurantiifolia en etanol no inhibiera el crecimiento micelial pudiera tener relación con que en este extracto se obtuvieron las menores concentraciones de fenoles totales.
La evaluación in vitro de la inhibición del crecimiento micelial de un hongo constituye una vía eficiente para determinar la actividad antifúngica de extractos de plantas. Existen pocos trabajos sobre la inhibición del crecimiento micelial de S. solani. No obstante, se ha informado la actividad antifúngica de aceites esenciales de Cuminum cyminum L. y Pimpinella anisum L (El-Said y Goder, 2014), así como de Artemisia alba Turra (Goudji et al., 2016), esta última relacionada con la presencia de compuestos terpenoides identificados como tujona, alcanfor y danavona. Según la literatura consultada, es la primera vez que se evalúa la actividad antifúngica de extractos de plantas frente a S. solani en función de la concentración de fenoles totales. Estos resultados fueron similares a los obtenidos con los aceites esenciales anteriormente referidos.
Inhibición de la germinación de los conidios
Todos los extractos evaluados, con excepción de C. aurantiifolia en metanol se consideraron promisorios para la inhibición de la germinación de conidios de S. solani, pues mostraron porcentajes de inhibición superiores al 50 % (Figura 2). Los extractos de C. aurantium var. sinensis en etanol y el de C. reticulata en metanol mostraron porcentajes de inhibición de la germinación de los conidios de 100 %, resultado que fue similar al obtenido cuando se empleó el fungicida sintético Tebuconazol.
La inhibición de la germinación de los conidios de S. solani por extractos de plantas ha sido poco estudiada. En este sentido, aceites esenciales de Plectranthus cylindraceus Hochst. ex Benth., a una concentración de 125 µg mL-1, inhibieron en un 70 % la germinación de los conidios de S. solani. La actividad antifúngica de estos aceites esenciales se justificó con la presencia del compuesto terpenoide carvacrol (Marwah et al., 2007). El porcentaje de inhibición de la germinación de los conidios mostrado por los extractos de Citrus spp. evaluados en este trabajo se realizó en función de la concentración de fenoles totales. Según la literatura consultada, es la primera vez que se realiza la determinación de la actividad antifúngica frente a S. solani basada en la concentración de compuestos fenólicos con resultados similares a los obtenidos con aceites esenciales.
CONCLUSIONES
Los extractos de C. aurantium var. sinensis en etanol y C. reticulata en metanol fueron los más efectivos en el control in vitro de S.solani, con resultados similares al fungicida comercial Tebuconazol, el cual es de uso común. Este trabajo demuestra la actividad antifúngica de estos extractos frente a S. solani, lo que sugiere una alternativa para su empleo como parte de una estrategia de manejo agroecológico de este hongo.
BIBLIOGRAFÍA
AMINI, M., N. SAFAIE, M. SALMANI, M. SHAMS. Antifungal activity of three medicinal plant essential oils against some phytopathogenic fungi. Trakia Journal of Sciences, 10 (1): 1-8, 2012.
BAHRAMINEJAD, S., R. AMIRI, S. ABBASI. Anti-fungal properties of 43 plant species against Alternaria solani and Botrytis cinerea. Archives of Phytopathology and Plant Protection, 48 (4): 336-344, 2015.
CASTILLO-REYES, F., HERNÁNDEZ-CASTILLO, F.D., CLEMENTE-CONSTANTINO, J.A., GALLEGOS-MORALES, G., RODRÍGUEZ-HERRERA, R., AGUILAR, C.N. In vitro antifungal activity of polyphenols-rich plant extracts against Phytophthora cinnamomi Rands. African Journal of Agricultural Research, 10 (50): 4554-4560, 2015.
CEDEÑO, L., CARRERO, C., RUÍZ, R., FERMÍN, G., PINO, H., QUINTERO, K. Primer reporte de Stemphylium solani en Lisiantus. Fitopatología Venezolana, 24 (2): 38-41, 2011.
CENTURIÓN, S.B., AQUINO, A., BOZZANO, G. Extractos vegetales para el control alternativo del damping-off causado por Rhizoctonia solani en plántulas de tomate. Investigación Agraria, 15 (1): 23-29, 2013.
ELOFF, J.N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica, 64 (8): 711-713, 1998.
EL-SAID, A.H., GODER, E. Antifungal activities of Cuminum cyminumand Pimpinella anisum essential oils. International Journal of Current Microbiology and Applied Sciences, 3 (3): 937-944, 2014.
GOUDJI, M.B., LADJEL, S., BENCHEIKH, S.E., HAMMOYA, F., BENSACI, M.B., ZIGHMI, S., MEHANI, M. Bioactivity of Artemisia Herba alba essential oil against plant pathogenic fungi. Der Pharma Chemica, 8 (3): 46-52, 2016.
IRKIN, R., DOGAN, S., DEGIRMENIOGLU, N., DIKEN, M.E., GULDAS, M. Phenolic content, antioxidant activities and stimulatory roles of citrus fruits on some lactic acid bacteria. Archives of Biological Sciences, 67 (4): 1313-1321, 2015.
KHALIL, A.B., DABANEH, B., ANFOKA, G. Antifungal activity of medicinal plants
from Jordan environment. Plant Pathology Journal, 4 (2): 130-132, 2005.
KARIMI, E., OSKOUEIAN, E., HENDRA, R., OSKOUEIAN, A., JAAFAR, H.Z.E. Phenolic compounds characterization and biological activities of Citrus aurantium bloom. Molecules, 17 (2): 1203-1218, 2012.
KAVITHA, K., MATHIYAZHAGAN, S., SENDHILVEL, V., NAKKEERAN, S., CHANDRASEKAR, G., DILANTHA FERNANDO, W.G. Broad spectrum action of phenazine against active and dormant structures of fungal pathogens and root knot nematode. Archives of Phytopathology and Plant Protection, 38 (1): 69-76, 2005.
LUNA-GUEVARA, M.L., DELGADO-ALVARADO, A. Importancia, contribución y estabilidad de antioxidantes en frutos y productos de tomate (Solanum lycopersicum L.). Avances en Investigación Agropecuaria, 18 (1): 51-66, 2014.
MADHURI, S., ASHWINI, U.H., SRILAKSHMI, N.S., PRASHITH, T.R. Antimicrobial activity of Citrus sinensis and Citrus aurantium peel extracts. Journal of Pharmaceutical and Scientific Innovation, 3 (4): 366-368, 2014.
MARWAH, R.G., FATOPE, M., DEADMAN, M., OCHEI, J., AL-SAIDI, S. Antimicrobial activity and the major components of the essential oil of Plectranthus cylindraceus, Muscat, Sultanate of Oman. Journal of Applied Microbiology, 103 (4): 1220-1226, 2007.
OJITO RAMOS, K., HERRERA, Y., VEGA, N., PORTAL, O. Actividad antioxidante in vitro y toxicidad de extractos hidroalcohólicos de hojas de Citrus spp. (Rutaceae). Revista Cubana de Plantas Medicinales, 17 (4): 368-379, 2012.
OMOBA, O.S., OBAFAYE, R.O., SALAWU, S.O., BOLIGON, A.A., ATHAYDE, M.L. HPLC-DAD phenolic characterization and antioxidant activities of ripe and unripe sweet orange peels. Antioxidants, 4 (3): 498-512, 2015.
ROMEO, F.V., G. BALLISTRERI, S. FABRONI, S. PANGALLO, M.G. Li DESTRI. Chemical characterization of different sumac and pomegranate extracts effective against Botrytis cinerea Rots. Molecules, 20 (7): 11941-11958, 2015.
SAHA, S., A.S.T. PURATH, M.R. JADHAV, M. LOGANATHAN, K. BANERGEE, A.B. RAI. Bioefficacy, residue dynamics and safety assessment of the combination fungicide trifloxystrobin 25 % + tebuconazole 50 %-75 WG in managing early blight of tomato (Lycopersicum esculentum Mill.). Journal of Environmental Science and Health, Part B, 49 (2): 134-141, 2014.
SILVA-ESPINOZA, B.A., ORTEGA-RAMÍREZ, L.A., GONZÁLEZ-AGUILAR, G.A., OLIVAS, I., AYALA-ZAVALA, J.F. Protección antifúngica y enriquecimiento antioxidante de fresa con aceite esencial de hoja de canela. Revista Fitotecnia Mexicana, 36 (3): 217-224, 2013.
Recibido: 03/01/2017
Aceptado: 08/06/2017