ARTÍCULO DE INVESTIGACIÓN
Infección de Pineapple mealybug wilt-associated virus 1,2 y 3 en plantas de piña, híbrido 'MD-2' en Ciego de Ávila
Pineapple mealybug wilt-associated virus 1, 2 and 3 infection, in pineapples hybrid 'MD-2' in Ciego de Ávila
Lester Hernández-Rodríguez1, Lelurlys Nápoles Borrero2, Luis Pérez Vicente3, Oscar Vitalio Concepción Laffitte2, Mariela Cid Ruiz2, Yilian Alvares Llanes1, Victoria Zamora Rodríguez1
1Instituto de Investigaciones en Fruticultura Tropical, Ave. 7ma No. 3005 e/30 y 32, Playa, La Habana, Cuba. CP 11300
2Centro de Bioplantas, UNICA. Carretera a Morón, km 9, Ciego de Ávila, Cuba. CP 69450
3Instituto de Investigaciones de Sanidad Vegetal. Calle 110 # 514 Esq. 5ta B, Playa, La Habana, Cuba. CP 11300
E-mail: fitopatología@iift.cu; lesterHernándeziift@gmail.com
RESUMEN
La etiología de la enfermedad marchitez de la piña (MWP) está asociada a un complejo de ampelovirus (Closteroviridae) nombrados Pineapple mealybug wilt-associated virus 1 al 5 (PMWaV-1 al -5). Los objetivos de este estudio fueron determinar la especie de PMWaVs asociada con los síntomas de MWP en plantas de piña, híbrido 'MD-2', y la presencia de estos virus en vitroplantas obtenidas a partir de coronas asintomáticas de este mismo cultivar. Se colectaron seis plantas con síntomas de MWP y 25 coronas asintomáticas en plantaciones comerciales de piña, híbrido 'MD-2', de Ciego de Ávila, durante el periodo 2010-2015. Las coronas se utilizaron como explantes para producir plantas "in vitro". A cada planta se le extrajeron los ARN para detectar PMWaV-1, -2 y -3 mediante RT-PCR. Cinco de las seis plantas con síntomas de MWP contuvieron PMWaV-2, de las cuales cuatro estuvieron co-infectadas con PMWaV-1 y/o PMWaV-3. De las 25 plantas "in vitro" obtenidas, el 40 % contuvo la infección, al menos por un PMWaV, el 16 % por las tres especies virales, el 8 % por dos especies y el 16 % por un virus. La incidencia de PMWaVs en todas las muestras fueron de 38,7 % para PMWaV-1 y PMWaV-3 (12/31), y 32,3 % para PMWaV-2 (10/31). En su conjunto, los resultados evidencian la necesidad de certificar el estado sanitario del material de propagación de piña.
Palabras clave: ampelovirus, marchitez, piña, PMWaV-1, PMWaV-2, RT-PCR, virus de plantas
ABSTRACT
The etiology of the mealybug wit of pineapple (MWP) disease is associated with a complex of ampeloviruses (Closteroviridae) named Pineapple mealybug wilt-associated virus-1 to -5 (PMWaV-1 to -5). The aims of this study were to determine the specie of PMWaVs associated with MWP symptoms in pineapples plants hybrid 'MD-2', and virus presence in asymptomatic crowns of the same cultivar. Six symptomatic plants and 25 asymptomatic crowns were collected in pineapples cv. 'MD-2' commercial fields in Ciego de Ávila, during the period 2010-2015. The crowns were used as explants to produce "in vitro" plants. Total RNAs were extracted to detect PMWaV-1, -2 and -3 by RT-PCR. Five of the six MWP symptomatic plants contained PMWaV-2 infection, four of them with mixed infection with PMWaV-1 and/or PMWaV-3. The forty percent of the 25 "in vitro" plants were infected, at least, by one PMWaV, 16 % of the three viral species, 8 % by two, and 16 % by only one virus. The incidence of PMWaVs was 38.5 % either for PMWaV-1 and PMWaV-3 (12/31), and 32.3 % for PMWaV-2 (10/31). These results indicate the need of the sanitary certification of pineapple propagation material.
Keywords: ampelovirus, wilt, pineapple, PMWaV-1, PMWaV-2, RT-PCR, plant viruses
INTRODUCCIÓN
La enfermedad marchitez de la piña (Ananas comosus (L.) Merr.) (MWP; del inglés Mealybug wilt of pineapple) es la principal enfermedad de origen viral que afecta la producción de este frutal en el mundo (Dey et al., 2015). La MWP produce una depauperación gradual de la planta que culmina en la muerte de la misma. Los síntomas más característicos son el enrojecimiento y bronceado de las hojas, la pérdida de turgencia, muerte foliar regresiva y reducción de la masa radicular (Sether y Hu, 2002a). Además, ocurren cambios en los ciclos de fructificación al mismo tiempo que disminuye el calibre de los frutos, los que aumentan su acidez y consistencia fibrosa hasta perder su valor comercial (Sether y Hu, 2002b).
Las pérdidas asociadas al desarrollo de MWP en plantas de piña se han determinado hasta un 35 % en Hawái (Sether y Hu, 2002b). Incluso, en ausencia de los síntomas de MWP, las infecciones por PMWaV se han correlacionado con las reducciones de los rendimientos que variaron desde el 5 % hasta el 15 % de la cosecha (Sether y Hu, 2001, 2002b).
Aunque la etiología de la enfermedad aún no se encuentra completamente definida, se ha identificado un complejo de cinco especies virales del género Ampelovirus, familia Closteroviridae, asociado a la MWP. Estos virus se nombraron Pineapple mealybug wilt-associated virus 1, 2, 3, 4 y 5 (acrónimos PMWaV-1, -2, -3, -4 y -5) (Sether et al., 2005, Gambley et al., 2008). En Hawái, PMWaV-2 es la especie que más se relacionó con la etiología de la MWP, causando síntomas severos de marchitez y reducción del rendimiento, pero solo en plantas infestadas con cochinillas (Hemiptera: Pseudococcidae).
Según Sether y Hu (2002a, b) la infección simple por PMWaV-1, ya sea en plantas con cochinillas o no, causa una disminución de los rendimientos pero no indujeron los síntomas de MWP. Sin embargo, en Australia Gambley et al. (2008) reposta que PMWaV-1 y PMWaV-3 se encuentran más relacionados a la presencia de síntomas de MWP que PMWaV-2. No obstante, las cinco especies virales se diseminan por el material de propagación infectado y se trasmiten por cochinillas, principalmente las rosadas (Dysmicoccus brevipes Cockerell) y las grises (Dysmicoccus neobrevipes Beardsley) (Gambley et al., 2008; Sether et al., 2010).
El desarrollo del cultivo de la piña en Cuba ha transitado por períodos de estimulación y depresiones. Las menguas se asociaron, entre otros factores, a la falta de suministros agrícolas, malas prácticas culturales y en gran medida, a la presencia de diferentes plagas (Isidrón et al., 2003). De forma similar que en otras regiones productoras de piña, se considera que el principal problema fitosanitario de este cultivo en Cuba es la enfermedad MWP, a la que se le han asociado pérdidas que alcanzan el 40 % de los rendimientos de las cosechas, donde se han descrito la presencia y amplia distribución de PMWaV-1, PMWaV-2, PMWaV-3 y Pineapple bacilliform comosus virus (PBCOV: Caulimoviridae, Badnavirus) (Hernández-Rodríguez et al., 2014).
El 2009 Cuba inició un programa para el cultivo intensivo del híbrido 'MD-2' en la Empresa Agroindustrial Ceballos, Ciego de Ávila (Rodríguez et al., 2012; López-Hernández y Domínguez-Martín, 2013). La adaptación del híbrido a las condiciones edafoclimáticas de esa provincia ha sido exitosa, de manera que se incrementa aceleradamente la extensión de la superficie plantada, su producción y mercado nacional e internacional (Rodríguez et al., 2012). Las nuevas plantaciones de piña se establecen por propagación vegetativa de material de propagación, principalmente los hijos de pedúnculos y claveles. Estos materiales se extraen a partir de plantaciones comerciales adultas, y son plantados en las nuevas áreas sin mediar certificación sanitaria alguna, previa a la siembra. Sin embargo, la apariencia asintomática de las plantas y el material de propagación no implica que se encuentren libres de agentes infecciosos, como los PMWaVs (Hu et al., 1997; Sether et al., 2005). Los objetivos de este estudio fueron: identificar la especie de PMWaVs en plantas de piña del híbrido 'MD-2' con síntomas de MWP, y la infección por PMWaV-1, PMWaV-2 y PMWaV-3 en plantas obtenidas a partir del cultivo "in vitro" de yemas extraídas a partir de coronas de plantas de piña 'MD-2' asintomáticas, colectadas en plantaciones comerciales.
MATERIALES Y MÉTODOS
Colecta de muestras en plantaciones comerciales de piña del híbrido 'MD-2'
Las muestras de plantas de piña del híbrido 'MD-2' se colectaron de la Unidad Estatal Básica (UEB) de Frutales, adjunta a la Empresa Agroindustrial Ceballos, provincia de Ciego de Ávila. Se realizaron tres prospecciones, las dos primeras en marzo de 2010 (plantación de cinco meses de edad) y octubre de 2012 (plantas con más de diez meses de sembradas) para localizar y colectar plantas adultas con síntomas de MWP, y asociar los síntomas a la detección de PMWaVs. Las plantas fueron fotografiadas y de cada una se tomó 100 mg del tejido blanco y blanduzco de la base de hojas, para realizar los ensayos de detección de PMWaVs.
La tercera prospección, realizada en enero de 2015, fue para verificar la presencia de PMWaVs en el material de propagación extraído de las plantaciones comerciales adultas y la eficiencia del protocolo de obtención de vitroplantas libres de la infección por los PMWaVs. Para eso se colectaron 25 coronas de plantas de piña del híbrido 'MD-2' seleccionadas en una plantación de la misma empresa, las plantas asintomáticas se utilizaron como material inicial para la obtención de vitroplantas.
Desinfección y establecimiento del explante inicial de piña 'MD-2'
Las coronas extraídas de las plantas madres se sumergieron de 3–5 min en una solución de fungicida Mancoceb (10 g L-1) o Previcur® Energy (1 mL L-1). Posteriormente se sembraron en bolsas de polietileno negras con sustrato zeolita y suelo rojo (1:1) bajo condiciones controladas en las casas de cultivo, Centro de Bioplantas, Ciego de Ávila. A las coronas aviveradas se les eliminaron las hojas cuidadosamente para no dañar las yemas axilares y posteriormente fueron sometidas a un lavado con detergente comercial. A la postre, se realizaron cuatro enjuagues con agua destilada estéril, y desinfectaron en la cabina de flujo laminar según el instructivo técnico para este cultivo. Seguidamente, se practicó una segunda desinfección a las yemas extraídas de las coronas de (4–6 mm) con su correspondiente enjuague, y colocaron individualmente en tubos de ensayos que contenían 10 mL de medio de cultivo semisólido de establecimiento (medio basal MS suplementado con sacarosa 3 % (m/v), myo-inositol 100 mg L-1, tiamina, HCl 1,0 mg L-1, bencilaminopurina 1 mL L-1 y ácido naftalenacético 1 mL L-1). Los tubos se colocaron en un cuarto de crecimiento (luz artificial o cuarto de luz solar) a una irradiancia de 50 µmol m-2 s-1 (3000 – 5000 lux) y una temperatura promedio de 25 ± 1 °C. Las plántulas fueron dejadas hasta que alcanzaron los 10–15 cm. Para los análisis de detección de PMWaV-1, PMWaV-2 y PMWaV-3 se seleccionó una vitroplanta obtenida de cada una de las coronas (25 muestras).
Material vegetal y obtención de los extractos de ARN total
Los ARN totales de las plantas adultas se extrajeron mediante el método del reactivo TRIzol LS (GIBCO, BLR), y los de las vitroplantas con el sistema RNeasy Plant Mini Kit (QIAGEN, Panamá), según las instrucciones del productor para muestras con alto contenido de carbohidratos. Cada vitroplanta de piña originada a partir de una corona se lavó para eliminar todo residuo de medio de cultivo y cortaron fragmentos de tejido blancuzco y suave de la base de las hojas. Además, fueron pesados 100 mg que se trituraron en morteros con congelación mediante nitrógeno líquido y los extractos de ARN se mantuvieron a -50 °C hasta su procesamiento.
Detección por RT-PCR de PMWaV-1, PMWaV-2 y PMWaV-3
Los ensayos de diagnóstico en las plantas adultas y las vitroplantas se restringieron a la detección de PMWaV-1, PMWaV-2 y PMWaV-3, especies asociadas con la enfermedad MWP (Sether y Hu, 2002a; Gambley et al., 2008). La detección se realizó con dos juegos de tres pares de cebadores específicos que dirigen la amplificación de un fragmento del gen que codifica para la proteína de choque térmico (HSP70h; 225/226 (PMWaV-1), 223/224 (PMWaV-2) y 263/264 (PMWaV-3)) (Sether et al., 2005), y el gen completo de la proteína de cápside viral (CP; CP227/CP228 (PMWaV-1), CP229/CP230 (PMWaV-2) y CP231/CP232 (PMWaV-3)) (Hernández-Rodríguez et al., 2014), según las concentraciones y condiciones descritas por ambos autores.
RESULTADOS Y DISCUSIÓN
Descripción de los síntomas de MWP en las plantas y coronas de piña 'MD-2'
En la primera prospección que se realizó fueron colectadas cuatro plantas (denominadas en este estudio con los números 1 – 4) que mostraron síntomas de necrosis en la punta de las hojas, curvaturas hacia abajo y apariencia general de marchitez y depauperación (Figura 1 A). Además, se observó un moteado amarillo en varias de sus hojas, pero no se observó la presencia del síntoma de enrojecimiento o bronceado de las hojas descritas para la MWP en otros cultivares de piña de Hawái (Sether y Hu, 2002a). De manera análoga, durante octubre de 2012 se localizaron dos plantas (nombradas en este estudio como 5 y 6) que presentaron síntomas similares a los descritos anteriormente (Figura 1 B). Sin embargo, la numerada como 6 presentó, además de los síntomas descritos, una mucosidad blanquecina similar a una infección causada por hongos. Por otro lado, las 25 coronas colectadas en las plantaciones de piña no mostraron síntoma. Las vitroplantas, generadas a partir de yemas de cada una de estas coronas, crecieron en el medio de multiplicación sin síntoma alguno, con una apariencia de buen estado de desarrollo vegetativo.
Detección de PMWaV-1, PMWaV-2 y PMWaV-3 en plantas de piña híbrido 'MD-2' con síntomas de MWP
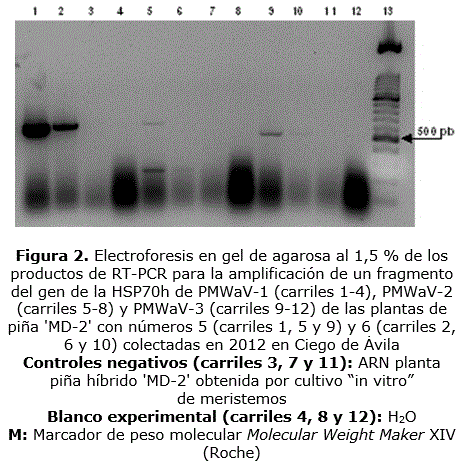
En los productos de la RT-PCR para la detección de PMWaV-1, PMWaV-2 y PMWaV-3 a partir de los ARN de las plantas de piña adultas, se amplificaron fragmentos de ADN del gen que codifica para la HSP70h con tallas aproximadas de 590 pb, 610 pb y 490 pb, respectivamente (Figura 2). Los pesos moleculares de estos amplicones coincidieron con los esperados, según el diseño de los cebadores utilizados (Sether et al., 2005). Estos resultados evidenciaron la presencia de los mencionados virus en las plantas de piña híbrido 'MD-2' con síntomas de MWP colectadas, ya sea en infecciones simples o mixtas (Tabla). La frecuencia de detección en las muestras de PMWaV-2 y PMWaV-3 fue de 83,3 % (5/6), mientras que PMWaV-1 mostró un valor de 66,6 % (4/6). La infección mixta más frecuente fue la de los tres virus en una misma planta (3/6) (plantas 1, 4 y 5), encontrándose la mezcla PMWaV-1 y -3 en la planta 6 y PMWaV-2 y PMWaV-3, en la 3. De la misma forma, solamente una planta poseyó una infección por una sola especie viral, PMWaV-2 (planta 2).
Detección de PMWaV-1, PMWaV-2 y PMWaV-3 en vitroplantas obtenidas a partir de coronas de piña 'MD-2' asintomáticas
La visualización de bandas definidas en la electroforesis en geles de agarosa al 1,5 % correspondientes a los ARN ribosomales 28S y 18S permitió verificar la obtención de los extractos de ARN total de las vitroplantas de piña en análisis (Figura 3, A). La electroforesis en gel de agarosa de las reacciones de RT-PCR para la amplificación del gen que codifica para la CP permitió verificar la amplificación de fragmentos con tamaños de 774 pb, 909 pb y 789 pb, los cuales se correspondieron con las tallas esperadas para la detección específica de PMWaV-1, PMWaV-2 y PMWaV-3, respectivamente (Figura 3 B, C y D) (Hernández-Rodríguez et al., 2014). Cuando se observaron señales débiles, las muestras se reprocesaron (solo fueron repetidas las reacciones de PCR) (Figura 3, B, carriles 5, 6, 8, 14, 22 y 23; C: 22 y 23; D: 6 y 23). La infección por el virus estudiado se correspondió con las muestras que resultaron positivas en todas las repeticiones, incluyendo los primeros análisis y los reprocesamientos.
De las 25 vitroplantas analizadas, 15 no presentaron infección por ninguna de las especies virales ensayadas (60 %) (Figura 4). La frecuencia de detección de cada una de las especies virales en las muestras analizadas fueron 32 % para PMWaV-1 (8/25), 20 % PMWaV-2 (5/25) y 28 % PMWaV-3 (7/25) (Figura 4 A). En cuatro a las 25 vitroplantas analizadas (16 %) se encontraron infecciones mixtas en las que se detectaron los tres ampelovirus que fueron incluidos en los diagnósticos (Figura 4, B). Otras plantas presentaron infecciones por dos de los tres virus analizados con la composición PMWaV-2 y PMWaV-3 (1/25: 4 %) y PMWaV-1 y PMWaV-3 (1/25: 4) (Figura 4, B).
Los análisis de diagnóstico para detectar la presencia de PMWaV-1, PMWaV-2 y PMWaV-3 en 31 muestras de piña del híbrido 'MD-2' (plantas y coronas), colectadas en plantaciones comerciales de la provincia de Ciego de Ávila, mostraron que más del 50 % se encontraron infectadas por uno o varios PMWaV. Estos son los primeros registros de porcentajes de detección de estos virus en estas plantaciones. Con anterioridad, Hernández-Rodríguez et al. (2014) caracterizaron molecularmente un aislado de cada una de estas especies virales recuperado en estas mismas plantaciones, pero no se analizaron frecuencias de detección en las áreas. Asimismo, los valores obtenidos coinciden con los informados por Hawái, EE.UU. (Sether et al., 2005, 2010), y Australia (Gambley et al., 2008). Estos resultados reafirman la necesidad de tomar medidas con el objetivo de disminuir la diseminación de los virus a las nuevas plantaciones.
Todas las plantas de piña 'MD-2' adultas con síntomas similares a los de MWP analizadas en este estudio, excepto una, se encontraron infectadas con PMWaV-2. De las cinco plantas infectadas con PMWaV-2, una contuvo una infección simple y las otras cuatro estuvieron coinfectadas con PMWaV-1 y PMWaV-3. Estos resultados sugirieron la asociación de PMWaV-2 a los síntomas de MWP observados. Hernández et al. (2010a) y Hernández-Rodríguez et al. (2014) encontraron evidencias de que PMWaV-2 es la especie asociada a los síntomas de MWP en el cv. Española roja, coincidentemente con lo reportado respecto a Hawái por Sether y Hu (2002a). Sin embargo, se necesitan estudios más profundos que demuestren definitivamente la asociación de esta especie viral con los síntomas de la enfermedad en estos cultivares.
Por otro lado, los síntomas de MWP en las plantas del híbrido 'MD-2' diagnosticadas difieren a los descritos para las plantas del cultivar Española roja en Cuba (Hernández-Rodríguez et al., 2013a; Hernández-Rodríguez et al., 2014), y Hawái (Sether y Hu, 2002a). Este es un aspecto que tiene particular importancia para la identificación de plantas de piña con síntomas donde debe realizarse su eliminación inmediata de las plantaciones 'MD-2' como medida de manejo de la enfermedad. En este sentido, Sether y Hu (2002a), informaron que las plantas de piña infectadas con PMWaVs no muestran síntomas visibles de la infección a menos que estén presentes PMWaV-2, e insectos cochinillas alimentándose de ellas.
La práctica usual para establecer nuevas plantaciones de piña en Cuba, y en otras regiones, es utilizar la semilla vegetativa a partir de plantas madres asintomáticas de campos donde se cosechó la fruta como material de propagación vegetativo. Estos materiales se encuentran frecuentemente infectados con alguna de las especies virales de PMWaVs, aunque no se observe síntoma alguno en las plantas fuentes de los propágulos (Sether et al., 2010). En este estudio, todas las plantas colectadas se encontraron infectadas por uno o varios PMWaVs. Además, el 40 % de las producidas "in vitro", a partir de yemas de coronas asintomáticas extraídas de las plantaciones comerciales prospectadas, contuvieron PMWaV-1, PMWaV-2 y/o PMWaV-3, ya sea en infecciones simples o mixtas. Esto evidencia el riesgo que representa la propagación de material colectado de plantaciones comerciales sin indexación sanitaria, y la necesidad de diagnosticar la presencia de PMWaVs previo a la propagación.
Sether et al. (2001), demostraron la eliminación de la infección por PMWaV-1 mediante el cultivo "in vitro" de meristemos. Sin embargo, la eliminación de PMWaV-1 se logró mediante la combinación de un pretratamiento con calor, y la posterior extracción de segmentos menores de 1 mm provenientes de las yemas axilares, para el establecimiento del cultivo "in vitro". Las diferencias entre los tamaños de yemas utilizados de este estudio con los utilizados por Sether et al. (2001), y la falta de pretratamientos con calor pudieran explicar la obtención de plantas infectadas con PMWaVs después del cultivo "in vitro".
Algunas de las vitroplantas generadas se encontraron infectadas con PMWaV-2 y no desarrollaron los síntomas de la enfermedad MWP. Varias razones pudieran explicar esta contradicción. Sether y Hu (2002a) demostraron que en ausencia de la infestación por cochinillas, no se desarrollan los síntomas de MWP. Asimismo, la infección que se detectó mediante RT-PCR pudiera encontrarse en estado latente, o las plantas, a partir de la cual se extrajeron las coronas, desarrollaron la MWP y ocurrió la reversión de los síntomas, fenómeno que se ha descrito en la literatura como una de las etapas de esta enfermedad por la que pueden transcurrir las plantas de piña (Py, 1968).
Así, en Cuba como en otras regiones del mundo, la tecnología con que se establecen nuevas áreas de piña constituye el principal factor de diseminación de estos patógenos. Una medida imprescindible para disminuir este riesgo, es el uso de fuentes de semilla certificada libre de virus. Estos programas sin embargo, requieren el apoyo de herramientas de diagnóstico rápidas, sensibles y específicas (Dey et al., 2012), así como la organización de procedimientos basados en buenas prácticas de producción para excluir la presencia de los virus en el material de plantación.
La metodología basada en la RT-PCR para la detección específica de PMWaV-1, -2 y -3 fue útil en la detección de las tres especies virales procedentes de materiales sintomáticos y asintomáticos, confirmando los resultados de estudios anteriores en los que se detectaron estos agentes en plantas adultas asintomáticas (Hernández et al., 2010a, 2010b; Hernández-Rodríguez et al., 2013b, 2014).
En este sentido, la tecnología de micropropagación es una herramienta eficaz, con ventaja sobre las técnicas tradicionales de propagación vegetal, ya que permite obtener gran número de plantas en poco tiempo y con mejor calidad (González-Olmedo et al., 2005). Estás técnicas pueden ser combinadas a esquemas convencionales de producción de semilla agámica con un mejor control fitosanitario de la plantación. Sin embargo, en Cuba se requieren entre 60 000 y 72 000 plantas ha-1 para el establecimiento de una plantación de piña del híbrido 'MD-2' (López-Hernández y Domínguez-Martín, 2013). La alta demanda de propágulos limita el uso de métodos de diagnóstico como la RT-PCR que debido a su alto costo, imposibilita la implementación de un programa para la producción de material de propagación certificado. Una solución posible a este impedimento es el diseño de un sistema de unidades productoras de material de propagación con diferentes niveles de cobertura en la certificación sanitaria, combinado con experiencias derivadas de estudios del comportamiento epidemiológico de la enfermedad en otros países. Sether et al. (2010) demostraron que los sectores centrales de bloques de piña tratados para el control de insectos vectores mantuvieron bajos niveles de incidencia de PMWaVs, inclusive hasta el momento de la cosecha de los retoños secundarios. Esta información debe ser sometida a estudio en el futuro y utilizada para la obtención de semillas.
CONCLUSIONES
Este trabajo demostró la presencia de PMWaV-1, PMWaV-2 y PMWaV-3 en plantas de piña del híbrido 'MD-2' de Ciego de Ávila, y se encontraron evidencias que pudieran indicar la asociación de PMWaV-2 con los síntomas de la enfermedad marchitez de la piña. Asimismo, las coronas colectadas en plantas asintomáticas de piña, y las plantas obtenidas a partir de la propagación "in vitro" de este material, contuvieron infecciones simples y mixtas por PMWaV-1, PMWaV-2 y PMWaV-3.
AGRADECIMIENTOS
Esta investigación se financió por el Ministerio de la Agricultura de Cuba (MINAG), y el Grupo Empresarial Agrícola de Cuba (GEAgric), mediante los proyectos nacionales P131LH003009 y 2034.
BIBLIOGRAFÍA
DEY, K.K., BORTH, W.B., MELZER, M.J., WANG, M.L., HU, J.S. Analysis of Pineapple Mealybug Wilt Associated Virus -1 and -2 for Potential RNA Silencing Suppressors and Pathogenicity Factors. Viruses, 7: 969–995, 2015.
DEY, K.K., LIN, H., BORTH, W.B., MELZER, M.J., HU, J.S. A highly sensitive single-tube nested PCR assay for the detection of Pineapple mealybug wilt associated virus-2 (PMWaV-2). Journal of Virological Methods, 183: 215–218, 2012.
GAMBLEY, C.F., STEELE, V., GEERING, A.D.W., THOMAS, J.E. The genetic diversity of ampeloviruses in Australian pineapples and their association with Mealybug wilt disease. Aust. Plant Pathol., 37: 95–105, 2008.
GONZÁLEZ-OLMEDO, J., FUNDORA, Z., MOLINA, L., ABDULNOUR, J., DESJARDINS, Y., ESCALONA, M. New contributions to propagation of pineapple (Ananas comosus L. Merr) in Temporary Immersion Bioreactors. "in vitro" Cellular Development of Biology-Plant, 41:87-90, 2005.
HERNÁNDEZ, L., RAMOS P.L., RODRÍGUEZ, M., ZAMORA, V., PEÑA, I., PÉREZ, J.M. Detección de ampelovirus asociados a la enfermedad de la marchitez de la piña (Ananas comosus (L.) Merr.) en la Isla de la Juventud, Cuba. CitriFrut, 27 (1): 39–46, 2010a.
HERNÁNDEZ, L., RAMOS, P.L., RODRÍGUEZ, M., PEÑA, I., PÉREZ, J.M. First report of Pineapple mealybug wilt associated virus-3 infecting pineapple in Cuba. New Disease Reports, 22: 18, 2010b.
HERNÁNDEZ-RODRÍGUEZ, L., RAMOS-GONZÁLEZ, P.L., GARCIA-GARCIA, G., ZAMORA, V., PERALTA-MARTIN, A.M., PEÑA, I., PEREZ, J.M., FERRIOL, X. Geographic distribution of mealybug wilt disease of pineapple and genetic diversity of viruses infecting pineapple in Cuba. Crop Protection, 65: 43–50, 2014.
HERNÁNDEZ-RODRÍGUEZ, L., RAMOS-GONZALEZ, P.L., GARCIA-GARCIA, G., ZAMORA, V., PEÑA, I., PÉREZ, J.M., FERRIOL, X. Diseminación de la enfermedad marchitez de la piña (Ananas comosus (L.) Merr.) en plantaciones comerciales de Cuba. CitriFrut, 30 (2): 43–54, 2013a.
HERNÁNDEZ-RODRÍGUEZ, L., RAMOS-GONZALEZ, P.L., GARCIA-GARCIA, G., JAVER HIGGINSON, E., ZAMORA-RODRÍGUEZ, V. First report of Pineapple bacilliform comosus virus (PBCoV) and endogenous Pineapple pararetrovirus-1 (ePPRV-1) in pineapple plants in Cuba. New Disease Reports, 28: 2, 2013b.
HU, J.S., SETHER, D.M., LIU, X.P., WANG, M., ZEE, F., ULLMAN, D.E. Use of a tissue blotting immunoassay to examine the distribution of pineapple closterovirus in Hawaii. Plant Dis., 81: 1150–1154, 1997.
ISIDRÓN, M., ROSALES, Y., PIFFERRER, A., CISNEROS, A., BENEGA, R., CARVAJAL, C. Caracterización del germoplasma de piña colectado en Cuba mediante prospección nacional: I. Localización, diversidad genética y situación actual. Cultivos tropicales, 24 (1): 65–71, 2003.
LÓPEZ-HERNÁNDEZ, D. Y DOMÍNGUEZ-MARTÍN, Q. El cultivo de la piña Cayena Lisa y sus selecciones en Cuba. CitriFrut, 30 (1): 62–66, 2013.
PY, C. LA PIÑA. Colección: Técnicas agrícolas y producciones tropicales. Ediciones revolucionarias, La Habana, Cuba. 1968, 245 p.
RODRÍGUEZ, R., VILLALOBO, A., PINO, Y., CONCEPCIÓN, O., MARTÍNEZ, E., GONZÁLEZ, J., SANTOS, R. Rapid Introduction of 'MD-2' Pineapple Using Micropropagation. Newsletter of the Pineapple Working Group. International Society for Horticultural Science, (19): 24, 2012.
SETHER, D.M. AND HU, J.S. Closterovirus infection and mealybug exposure are necessary for the development of mealybug wilt of pineapple disease. Phytopathology, 92: 928–935, 2002a.
SETHER, D.M. AND HU, J.S. Yield impact and spread of Pineapple mealybug wilt associated virus-2 and mealybug wilt of pineapple in Hawáii. Plant Dis., 86: 867–874, 2002b.
SETHER, D.M., AND HU, J.S. The impact of Pineapple mealybug wilt-associated virus-1 and reduced irrigation on pineapple yield. Australas Plant Pathol, 30: 31–36, 2001.
SETHER, D.M., BORTH, W.B., MELZER, M.J., HU, J. Spatial and temporal incidences of Pineapple mealybug wilt-associated viruses in pineapple planting blocks. Plant Dis., 94: 196–200, 2010.
SETHER, D.M., KARASEV, A.V., OKUMURA, C., ARAKAWA, C., ZEE, F., KISLAN, M.M., BUSTO, J.L., HU, J.S. Differentiation, distribution, and elimination of two different Pineapple mealybug wilt-associated viruses found in pineapple. Plant Dis., 85: 856–864, 2001.
SETHER, D.M., MELZER, M.J., BUSTO, J., ZEE, F., HU, J.S. Diversity and mealybug transmissibility of ampeloviruses in pineapple. Plant Dis., 89: 450–456, 2005.
Recibido: 21/06/2016
Aceptado: 15/12/2016