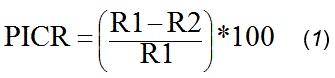
ARTÍCULO DE INVESTIGACIÓN
Empleo de rizobacterias para la protección de plantas de frijol frente al tizón ceniciento (Macrophomina phaseolina)
Use of rhizobacteria for the protection of bean plants against thecharcoal rot (Macrophomina phaseolina)
Dienelys Hernández Pérez1, Manuel Díaz Castellanos1, Reinaldo Quiñones Ramos1, Ramón Santos Bermúdez2, Nayanci Portal González3, Lidcay Herrera Isla1
1Facultad de Agronomía. Universidad Central "Marta Abreu" de Las Villas. Carretera a Camajuaní km 5 ˝. Santa Clara, Villa Clara, Cuba, CP 54830
2Facultad de Ingeniería Agropecuaria. Universidad Estatal Amazónica. Campus principal km 2 ˝ vía a Napo, Puyo, Ecuador. CP 160150
3Facultad de Ciencias Agrícolas. Universidad de Ciego de Ávila. Carretera a Morón km 9 ˝. Cuba. CP 69450
E-mail: lidcayhi@uclv.edu.cu
RESUMEN
Se evaluó la inhibición "in vitro" del crecimiento micelial de Macrophomina phaseolina (Tassi) Goid por cuatro rizobacterias, así como el control de la enfermedad en campo con el uso de medios biológicos y productos naturales. Aunque ninguna de las cepas bacterianas ensayadas logró inhibir totalmente el crecimiento de M. phaseolina "in vitro" a través de los bioensayos empleados, el control de la enfermedad bajo condiciones semicontroladas fue más eficiente con el empleo Bacillus cepacia y Pseudomonas fluorescens, sin diferencias estadísticas respecto al control químico. En las evaluaciones de campo todos los tratamientos redujeron significativamente la incidencia de la enfermedad detectada en las plantas, sin diferencias significativas entre ellos. A pesar de que las condiciones de humedad imperantes, durante las evaluaciones, se constató la efectividad de los tratamientos en la protección de plantas de frijol. Las evaluaciones de campo para las dos localidades y condiciones climáticas diferentes, evidenciaron que el tratamiento de las semillas de frijol con los medios biológicos (B. subtilis y P. fluorescens) permitió la protección del cultivo frente a la enfermedad causadas por M. phaseolina similar a la protección brindada por el control químico.
Palabras claves: agricultura orgánica, control biológico, patógenos del suelo, Phaseolus vulgaris L., rizobacterias
ABSTRACT
The "in vitro" growth inhibition of M. phaseolina by four rhizobacteria as well as disease management on field with the use of biological media and natural products were evaluated. Although none of the tested bacterial strains achieved completely inhibit the growth of the pathogen "in vitro" through both bioassays employed, the control of disease under controlled conditions was more efficient with the use of B. cepacia and P. fluorescens. During field assessments, M. phaseolina was the most prevalent fungal pathogen in bean crops, however, all tested treatments significantly reduced the impact of the disease. Despite the fact that moisture conditions prevailing during the crop assessments did not encourage the development of M. phaseolina, the effectiveness of the treatments for full protection of bean plants toward this soilborne fungus. Field assessments in two different locations and weather conditions show that treatment of bean seeds with biological media (B. subtilis and P. fluorescens) allows crop protection against disease caused by M. phaseolina.
Keywords: organic farming, biological control, soil pathogens, Phaseolus vulgaris L., rhizobacteria
INTRODUCCIÓN
En Cuba, el consumo de frijol goza de una larga tradición y gran demanda. Constituye uno de los granos fundamentales en la alimentación del pueblo, siendo un alimento de preferencia en la dieta diaria. Su aceptable contenido de proteínas lo sitúan como un cultivo estratégico del país.
Las enfermedades son uno de los factores principales que reducen los rendimientos del frijol en muchos lugares donde se cultiva. Entre los organismos causantes de enfermedades se encuentran los hongos fitopatógenos del suelo, existiendo en países de clima subtropical condiciones favorables para el desarrollo y proliferación de los mismos.
Los hongos fitopatógenos del suelo constituyen un grupo de microorganismos que por su hábitat y relaciones ecológicas con otros grupos requieren métodos particulares, tanto para su estudio como para su combate, si se les comparan con los productores de enfermedades foliares y de almacén (Herrera, 2004). Macrophomina phaseolina (Tassi) Goid es considerado un gran problema en el sur de los Estados Unidos, el Caribe, América Central y Sudamérica, pues provoca grandes pérdidas en diferentes cultivos, entre los que se destaca el frijol común. La presencia de M. phaseolina es la causa de la descalificación de las legumbres como material de propagación.
M. phaseolina infecta más de 500 especies de plantas y tiene una amplia distribución geográfica. Este patógeno del suelo causa daños significativos principalmente en frijol común, sorgo, ajonjolí y soya. El alto rango de hospederos ha complicado el trabajo de los fitomejoradores en la búsqueda de resistencia genética (Mora y Blumm, 1990). Por otra parte, los intentos de control químico han sido infructuosos debido a la poca persistencia de los productos químicos, la existencia de un vasto número de hospederos, proliferación, así como abundante producción de esclerocios que son viables en el suelo por varios años.
Debido a que el control químico del patógeno es costoso, el control cultural es difícil de aplicar, y se carece de variedades resistentes, hay que explorar otras alternativas, entre las que se encuentra el control biológico en el marco de un manejo integrado de la enfermedad. A pesar del avance en el empleo de métodos de control biológico para la protección de plantas, pocos estudios se han conducido en las condiciones edafoclimáticas de la región central de Cuba, por lo que el presente trabajo estuvo encaminado a evaluar el efecto de rizobacterias y productos naturales con tales fines.
MATERIALES Y MÉTODOS
El presente trabajo se desarrolló en el Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias, perteneciente a la Universidad Central "Marta Abreu" de Las Villas (UCLV) y los laboratorios de Sanidad Vegetal Provincial de Ciego de Ávila. Se evaluó el efecto antagónico de cuatro bacterias (Bacillus subtilis, B. cepacia, Pseudomonasfluorescens y P. aeruginosa) y el efecto protectante de los compuestos naturales quitosana en su formulación comercial Chitoplant® y Fungend, y como control químico el producto comercial bis (dimetilcarbamoil) disulfuro (TMTD 80 % PH) sobre M. phaseolina.
Material vegetal
Para todos los ensayos se emplearon semillas de frijol de la variedad BAT-482 (Blanca), según el registro oficial de variedades comerciales (MINAGRI, 2009).
Procedimientos generales
Salvo en los casos que se declara puntualmente, el método para aplicar los medios biológicos fue la peletización de las semillas. Los tratamientos empleados en los diferentes experimentos son los siguientes:
Control absoluto (sin aplicación)
Burkholderia cepacia (cepa CCIBP556W) procedente del Laboratorio de Microbiología del Instituto de Biotecnología de las Plantas (IBP), con una concentración de 4,6*109 UFC (Unidades Formadoras de Colonias)
Bacillus subtilis (cepa ATCC 6051) procedente del Laboratorio de Microbiología de la Universidad de Gent, Bélgica; con una concentración de 1,8*108 UFC.
Pseudomonas aeruginosa (cepa 7NSK2) procedente del Laboratorio de Fitopatología de la Facultad de Agronomía y Ciencias Biológicas Aplicadas de la Universidad de Gent, Bélgica con una concentración de 1,7*108 UFC.
Pseudomonas fluorescens (cepa CMR12) procedente del Laboratorio de Fitopatología de la Facultad de Agronomía y Ciencias Biológicas Aplicadas de la Universidad de Gent, Bélgica; con una concentración de 5,6*109 UFC.
Chitoplant® (Quitosana 99,9 %) al 0,1 %. El método de aplicación fue inmersión de las semillas durante una hora.
Fungend al 0,05 %, que constituye una mezcla de aceites de tres plantas (sésamo, maíz y girasol). Se aplicó el método de inmersión de las semillas por una hora.
Control químico Tetrametil Tiuram Disulfuro (TMTD 80 % PH) a una dosis de 3 g L-1. El método de aplicación fue inmersión de las semillas durante 10 minutos.
La obtención de los inoculantes bacterianos se realizó mediante el empleo de medios líquidos de caldo nutriente (Acumedia, Brasil) en el caso de B. subtilis y medio de cultivo King-B para el caso de P. fluorescens con la siguiente composición: proteosa peptona (20 g L-1), K2HPO4 (1,5 g L-1), MgSO4*7H2O (1,5 g L-1), glicerol (15,0 ml L-1), agar (15 g L-1). Los medios de cultivos fueron esterilizados en autoclave vertical a 121 ºC y 1,2 Kg cm-2 de presión por 15 minutos. Los microorganismos se mantuvieron en condiciones óptimas de crecimientos (28 ± 1 ºC), durante 24 horas. Estos cultivos, previa evaluación de sus concentraciones (108 UFC ml-1), fueron utilizados como soluciones para el tratamiento de las semillas.
Para la peletización con bacterias, estas se activaron en 5 ml de caldo nutriente durante 48 h, posteriormente se multiplicaron en un Erlenmeyer con 100 ml de caldo nutriente, se colocaron en una zaranda orbital Gerhardt durante 24 h a 30 ºC, luego se adicionó zeolita para la absorción de las bacterias y se secó al aire durante 48 h, se cubrió la semilla con la zeolita húmeda y el medio biológico utilizando almidón de yuca al 8 % como material adherente y se secó nuevamente al aire durante 48 h para ser sembradas.
Como microorganismo patógeno, se trabajó con el hongo M. phaseolina, obtenido del cepario depositado en el Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias perteneciente a la Universidad Central "Marta Abreu" de Las Villas, el que fue sembrado en placas de Petri (9 cm) sobre el medio de cultivo Papa Dextrosa Agar (PDA) y mantenidos a 28 ºC durante siete días. Para su multiplicación se transfirieron discos de 1 cm de diámetro a Erlenmeyers previamente esterilizados en autoclave a 120 ºC durante una hora, los cuales se incubaron a 28 ºC durante 15 días.
Las evaluaciones consistieron en la determinación del número de plantas sanas y enfermas según el agente causal. Para esto se realizaron observaciones de la morfología de los hongos filamentosos asociados con las muestras vegetales mediante el uso del microscopio clínico (Leitz, Alemania) en los laboratorios de Sanidad Vegetal de Ciego de Ávila y de Fitopatología de la Facultad de Ciencias Agropecuarias de la UCLV.
Efecto in vitro de bacterias antagonistas sobre M. phaseolina Se realizaron dos ensayos para evaluar el efecto antagónico de las rizobacterias B. subtilis, B. cepacia, P. fluorescens y P. aeruginosa sobre el hongo fitopatógeno del suelo que afecta al cultivo del frijol. Los métodos estudiados fueron: cultivo dual (doble capa) y difusión en agar (método de los pocillos).
Cultivo Dual o Doble Capa: se utilizó Agar Nutriente (AN) en placas de Petri (9 cm de diámetro), las cuales fueron inoculadas con las diferentes rizobacterias en forma de zigzag, incubándose a 28 ºC durante 24 horas. Posteriormente se adicionó una capa de PDA al 2 % y colocó un disco de un cultivo puro de hongos de 0,5 cm de diámetro en el centro de la placa. Se realizaron evaluaciones desde las 24 hasta las 72 horas.
Método de los Pocillos: Las cepas bacterianas se activaron en 5 ml de caldo nutriente e incubaron a 28 ºC ± 1 por 48 horas en condiciones estáticas. Luego en placas de Petri con medio de cultivo AN se hicieron dos perforaciones con un perforador de tapones de 0,5 cm de diámetro en extremos opuestos de la placa. A estos se les añadió 0,1 ml de suspensión bacteriana, seguidamente se colocó un disco de cada hongo estudiado de 0,5 cm de diámetro en el centro de la placa, incubándose a 28 ºC ± 1 evaluándose el crecimiento desde 24 a 72 horas.
Para ambos métodos se calculó la inhibición del crecimiento micelial que ejerció cada una de las rizobacterias sobre los hongos estudiados mediante el porcentaje de inhibición del crecimiento radial (PICR) según Rahman et al. (2007) (Ecuación). Como control se recurrió al caldo de cultivo sin inocular en lugar de la suspensión bacteriana. Para cada cepa bacteriana se emplearon tres réplicas.
donde,
R1 – diámetro de crecimiento micelial de M. phaseolina en ausencia de la rizobacteria
R2 – diámetro de crecimiento micelial en presencia de la rizobacteria
Evaluaciones en condiciones semicontroladas
Se utilizó un diseño en bloques al azar con tres repeticiones. La siembra se realizó a una distancia de 0,45 x 0,07 m en ambos casos. Las parcelas tenían cuatro surcos de 5 m lineales (6,75 m2). Se cuantificó la proporción de plantas sanas según el agente causal para cada uno de los siguientes tratamientos: (1) Control Absoluto (Plantas no tratadas), (2) Control químico (TMTD 80 % PH, 3 g L-1), (3) P. aeruginosa, (4) P. fluorescens, (5) B. subtilis (6) B. cepacia, (7) Fungend (0,05 %), (8) Quitosana (0,1 %).
Evaluaciones en condiciones de campo
Para la protección de las semillas y la siembra se emplearon los procedimientos previamente descritos en el recubrimiento de las semillas y la siembra en condiciones semicontroladas respectivamente. Las respectivas evaluaciones se realizaron en las siguientes localidades de Santa Clara, Cuba.
Estación Experimental Agrícola "Álvaro Barba Machado": el cultivo se mantuvo en condiciones de secano, no se aplicaron fertilizantes ni emplearon químicos para el control de las plagas. Las atenciones culturales consistieron en el control mecánico de malezas. Se evaluó la proporción de plantas enfermas por cada agente causal en los siguientes tratamientos: (1) Control Absoluto (Plantas no tratadas), (2) Control químico (TMTD 80 % PH, 3 g L-1), (3) P. fluorescens, (4) B. subtilis, (5) Fungend 0,05 %, (6) Quitosana 0,1 %.
Finca Agricultura Urbana: las atenciones culturales se desarrollaron según el instructivo técnico del Ministerio de Agricultura (MINAGRI, 2000). Se evaluó la proporción de plantas enfermas por cada agente causal en los siguientes tratamientos: (1) Control Absoluto (Plantas no tratadas), (2) Control químico (TMTD 80 % PH, 3 g L-1), (3) P. fluorescens, (4) B. subtilis.
Los datos se procesaron estadísticamente mediante el uso del paquete estadístico STARTGRAPHICS versión 15.0 sobre Windows, luego de la comprobación de los supuestos de la normalidad y homogeneidad de varianza, usando las pruebas de Kolmogorov-Smirnov y Levene, respectivamente. Se utilizaron pruebas paramétricas de comparación de medias (ANOVA, Tukey) y pruebas no paramétricas (Kruskal-Wallis, Student-Newman-Keuls).
RESULTADOS Y DISCUSIÓN
Al evaluar el efecto in vitro de bacterias antagonistas sobre M. phaseolina a través del ensayo del Cultivo Dual o Doble Capa, ninguna de las cepas bacterianas biocontroladoras ensayadas lograron inhibir totalmente el crecimiento micelial (Tabla 1). Los mayores niveles de inhibición del crecimiento se obtuvieron con la bacteria B. subtilis, aunque sin diferencias significativas con P. fluorescens y B. cepacia. Niveles inferiores de este indicador fueron alcanzados por la cepa de P. aeruginosa.
El efecto antagónico sobre el crecimiento de M. phaseolina (Tabla 2), evaluado por el método de los pocillos, tampoco mostró en ninguno de los tratamientos la inhibición total del crecimiento micelial. Los mayores porcentajes de inhibición se lograron con B. cepacia, seguido por P. aeruginosa y P. fluorescens.
B. subtilis no mostró efecto antagónico sobre el patógeno; sin embargo, Castellanos et al. (2004) encontraron que esta bacteria inhibió los crecimientos de más de 20 especies de hongos, pertenecientes a 17 géneros. Igualmente, López (2006) evaluó el antagonismo "in vitro" de aislados de Bacillus spp. contra Sclerotium rolfsii, Rhizoctonia solani y Pythium aphnanidermatum, a través del método de enfrentamiento dual. De 323 aislados nativos, 17 mostraron efecto antagónico. En nuestro caso, la cepa de B. subtilis empleada inhibió en más del 78 % el crecimiento micelial.
Bajo condiciones semicontroladas los mejores resultados se obtuvieron con el empleo de B. cepacia y P. fluorescens, sin diferencias estadísticas con el control químico (TMTD 80 % PH) (Figura 1). En sentido general, todos los tratamientos redujeron significativamente la proporción de plantas enfermas, respecto al tratamiento control.
Las rizobacterias superaron los productos naturales en la protección de las plantas frente a este patógeno. Resultados similares fueron obtenidos por Toledo et al.(2002) al evaluar el efecto antagónico "in vivo" de B. cepacia ante Fusarium sp. en el gladiolo (Gladiolus sp.).
Aunque la cepa de B. subtilis no mostró efecto antagónico sobre el patógeno por el método de los pocillos, la misma resultó ser la más eficiente en el método de cultivo dual, resultado que corrobora lo obtenido por González y Fragoso (2002) cuando controlaron numerosas enfermedades fúngicas en diversos cultivos con cepas de B. subtillis.
De manera general, el tratamiento a las semillas con rizobacterias y compuestos naturales protegen las plantas frente a este fitopatógeno en condiciones semicontroladas al evidenciarse una efectividad similar al control químico (TMTD 80 % PH) en todos los casos.
En las evaluaciones de campo desarrolladas, las efectuadas en la Estación Experimental Agrícola, mostraron que M. phaseolina es el patógeno fúngico de mayor incidencia sobre el frijol, con una proporción de plantas enfermas de 0,36 (Figura 2). Esta incidencia estuvo dada por las condiciones de sequía y altas temperaturas que predominaron durante el ciclo del cultivo. Este organismo patógeno durante los períodos prolongados de déficit de humedad en el suelo y altas temperaturas ambientales puede ocasionar pérdidas totales en los rendimientos del frijol común y otras especies de importancia económica como la soya, entre otras.
Según Abawi y Pastor-Corrales (1990) el desarrollo del tizón ceniciento es favorecido por el déficit hídrico y las temperaturas elevadas, condiciones que ocurren con frecuencia durante el desarrollo del frijol en México. La reacción a la enfermedad varía dependiendo del ambiente, el genotipo del hospedante y su interacción (Mayek et al., 2001). Este patógeno es un habitante común de los suelos y se puede trasmitir por la semilla infectada.
Respecto a los tratamientos para controlar este patógeno, todos redujeron significativamente la incidencia de la enfermedad, sin mostrar diferencias significativas entre ellos. Los géneros de bacterias más ampliamente usados como agentes de control biológicos son Bacillus y Pseudomonas, estos microorganismos producen varios compuestos que afectan el desarrollo de otros organismos (Chu et al., 2010; da Silva et al., 2014).
La superficie de raíces de Arabidopsis sp. tratadas con B. subtilis al ser analizadas demostraron que la formación de biofilmes por esta bacteria es un proceso complejo que incluye la secreción de surfactina, un polipéptido con características antimicrobianas (Bais et al., 2003). Villela-Marroni (2015) al evaluar la eficiencia de 19 aislados de Bacillus sp. En el control de M. phaseolina, demostró que los aislados de Bacillus sp. resultaron ser productores de compuestos antifungales y protectores efectivos de las posturas frente a la infección por este hongo.
Vallabhaneni (2016) observó una actividad antagónica de cepas de P. fluorescens en la rizosfera de plantas de tabaco frente a R. solani. Independientemente de las diferencias en la dinámica y capacidad de colonización de seis aislados de P. fluorescens en sayado sin vitro, todos indujeron el crecimiento de plantas de tabaco y redujeron los síntomas de la enfermedad; lo cual indicó que el establecimiento de aislados de P. fluorescens en la rizosfera de tabaco era una alternativa factible para el manejo de R. solani.
Las cepas de Pseudomonas ejercen múltiples mecanismos antagonistas y son promotoras del crecimiento vegetal, por lo que representan una excelente opción para ser utilizadas como agentes de biocontrol y promover además, el crecimiento de las plantas (di Francesco et al., 2016).
A pesar de que las condiciones de humedad imperantes durante las evaluaciones al cultivo, en la Finca de Agricultura Urbana, no se vio favorecido el desarrollo de M. phaseolina y por esta razón el número de plantas afectadas fue muy bajo. Las efectividades de los tratamientos sobre la protección de plantas no mostraron diferencias significativas, pero si con relación al control.
CONCLUSIONES
El tratamiento de las semillas de frijol con los medios biológicos (B. subtilis y P. fluorescens) permitió la protección del cultivo frente a la enfermedad causada por M. phaseolina, y por ende constituye una herramienta para la protección de plantas y el manejo agroecológico del cultivo.
Abawi, G.S., Pastor-Corrales, M.A. Root rot of beans in Latin American and Africa: Diagnosis, Research, Methodologies, and Management Strategies. CIAT, Cali, Colombia. Resúmenes Analíticos sobre Frijol, 3 (68): 114 p, 1990.
Bais, H.P., R. Fall, J. M. Vivanco. Biocontrol of Bacillus subtilis against Infection of Arabidopsis Roots by Pseudomonas syringae Is Facilitated by Biofilm Formation and Surfactin Production. Plant Physiol., vol 134: 307-319, 2003.
Castellanos, J.A., L. Ortiz, P. Oliva, J.M. Dueñas, J. Fresneda, S. Fraga, O. Meléndez. Estudios relacionados con el uso de Bacillus subtilis en el control de hongos fitopatógenos. AS-E.3. INIFAT. Cuba. VI Simposio de Agricultura sostenible. XIV Congreso Científico. INCA, La Habana, Cuba. Nov. 9-12, 2004, 60 p.
Chu, G.X., S.A. Wakelin, L. Condron, A. Stewart. Effect of soil copper on the response of soil fungal communities to the addition of plant residues. Pedobiologia, vol 53: 353-359, 2010.
da Silva, F.C., A.G. de Oliveira, L. Lopes-Santos, J.P. de Oliveira Beranger, M.V. Torres Cely, A.S. Simionato (et al.). Evaluation of antibiotic activity produced by Pseudomonas aeruginosa LV strain against Xanthomonas arboricola pv. pruni. Agricultural Sciences, 5 (1): 71-76, 2014.
di Francesco, A., C. Martini, M. Mari. Biological control of postharvest diseases by microbial antagonists: how many mechanisms of action? European Journal of Plant Pathology, vol 32: 1-7, 2016.
González, V., S. Fragoso. Bacillus subtilis. 2002. Disponible en: htpp://www.2.cbm.uam.es.html Consultado el 15 de mayo del 2006.
Hernández-León, R., D. Rojas-Solís, M. Contreras-Pérez, M.C. Orozco-Mosqueda, L.I. Macías-Rodríguez, H. Reyes-de la Cruz (et al.). Characterization of the antifungal and plant growth-promoting effects of diffusible and volatile organic compounds produced by Pseudomonas fluorescens strains. Biological Control, vol. 81: 83-92, 2015.
Herrera, L. Los hongos fitopatógenos el suelo en Cuba. Tesis presentada para la obtención del científico de Doctor en Ciencias, Universidad Central "Marta Abreu" de Las Villas, Santa Clara, Vila Clara, Cuba. 2004, 287 p.
López, M. Contribución al estudio de la microbiota patógena de la caña de azúcar. Tesis en opción al grado científico de Doctor en Ciencias Agrícolas. INISAV, La Habana, Cuba. 2006, 103 p.
Mayek, N., C. López, M. González, R. García, J. Acosta, O. Martínez, J. Simpson. Variability of Mexican isolates of M. phaseolina based on patogenicity and AFLP genotypes. Physiological and Molecular Plant Pathology, vol. 59: 227-264, 2001.
Mora, F., K.L. Blumm. Virulencia de aislamientos locales de R. solani en frijol de invernadero. Agronomía Costarricense, 14 (2): 247-250, 1990.
Toledo, Y., A. Hernández, M. Álvarez, G.M. Martin, R. Márquez. Determinación de efecto antifúngico de un biopreparado a partir de una cepa de Burkholderia cepacia ante Fusarium sp. en el cultivo del gladiolo (Gladiolus sp.). Cultivos Tropicales, 23 (4): 32-37, 2002.
Vallabhaneni, S.D. Biocontrol of Rhizoctonia solani in Tobacco (Nicotiana tabacum) Seed Beds Using Pseudomonas fluorescens. Agricultural Research, 5 (2): 137-144, 2016.
Villela-Marroni, I. Screening of bacteria of the genus Bacillus for the control of the plant-pathogenic fungus Macrophomina phaseolina. Biocontrol Science and Technology, 25 (3): 302-315, 2015.
Recibido: 24/03/2016
Aceptado: 10/11/2016