ARTÍCULO DE INVESTIGACIÓN
Efecto de medios biológicos y productos naturales sobreSclerotium rolfsii Sacc. en frijol común
Effects ofbiological resources and natural products onSclerotium rolfsii Sacc.incommon bean
Dienelys Hernández Pérez1, Manuel Díaz Castellanos1, Reinaldo Quiñones Ramos1, Ramón Santos Bermúdez2, Nayanci Portal González3, Lidcay Herrera Isla1
1Facultad de Agronomía. Universidad Central Marta Abreu de Las Villas. Carretera a Camajuaní km 5 ½. Santa Clara, Villa Clara, Cuba, CP 54830.
2Facultad de Ingeniería Agropecuaria. Universidad Estatal Amazónica. Campus principal km 2 ½ vía a Napo. Puyo. Ecuador. CP 160150.
3Facultad de Ciencias Agrícolas. Universidad de Ciego de Ávila. Carretera a Morón km 9 ½. Cuba. CP 69450.
E-mail:lidcayhi@uclv.edu.cu; monguy@gmail.com
RESUMEN
Se desarrollaron experimentos en condiciones de laboratorio, semicontroladas y de campo para evaluar la efectividad de medios biológicos y productos naturales en la protección de plantas de frijol común frente a la enfermedad causada por S. rolfsii. En las evaluaciones in vitro se comprobó el efecto antagónico de las rizobacterias Pseudomonasaeruginosa,Bacilus subtilis, Burkholderia cepaciay Pseudomonasfluorescensfrente a este fitopatógeno; mientras las dos primeras inhibieron completamente el crecimiento in vitro del patógeno, las dos últimas sólo lo hicieron en un 80,72% y 40,97% respectivamente usando el método del cultivo dual. Niveles inferiores de inhibición para cada caso se registraron con el empleo del método de los pocillos. Para las evaluaciones en condiciones semicontroladas y de campo, en adición a los medios biológicos previamente referidos, se evaluó el efecto de los productos naturales Fungend y Quitosana en la protección de las plantas de frijol. Los tratamientos con P.fluorescens, P.aeruginosa y Bacilus subtilis fueron similares a los logrados con el control químico (TMTD 80 % PH). Tanto la aplicación de los medios biológicos como de los productos naturales redujeron significativamente las afectaciones por esta especie de hongo del suelo, con porcentajes de plantas enfermas inferiores a las de los controles no tratados y similares al control químico.
Palabras clave: agricultura orgánica, biocontrol, Phaseolus vulgaris L., productos naturales, rhizobacterias
ABSTRACT
Several experiments were developed under laboratory, semi controlled and field conditions to assess effectiveness of biological resources and natural products on protecting common bean plants against disease caused by S. rolfsii. Antagonist effect of P.aeruginosa, B. subtilis, B.cepacia and P.fluorescens rhizobacterias was found. While the first two completely inhibited the in vitro growth of the pathogen the last two just did in an 80.72% and 40.97% respectively using the dual culture method. Lower levels of inhibition for each case were recorded by the use of the method of the wells. For evaluations under controlled conditions and field, in addition to the previously mentioned biological means, the effect of natural products Fungend and Chitosan in the protection of bean plants was evaluated. Treatments with P. fluorescens, P. aeruginosa and B. subtilis were similar to those achieved with chemical control (TMTD 80% PH). Affections by the pathogen were reduced for both the application of biological resources as well as natural product, in any case diseased plants were lower than non-treated plants and similar to chemical control.
Keywords: organic farming, biocontrol, Phaseolus vulgaris L., natural products, rhizobacteria
INTRODUCCIÓN
El frijol común (Phaseolus vulgaris L.) es la leguminosa de mayor importancia a escala mundial, representan el 57 % de las leguminosas comercializadas en el mundo. Constituye la fuente más barata de proteína, por lo que es un componente indispensable en la dieta y una fuente importante de ingresos para los pequeños productores (Martínez et al., 2004). Esto es especialmente evidente si se considera que el frijol común se ubica entre los cinco cultivos con mayor superficie dedicada a la agricultura en todos los países latinoamericanos.
En Cuba, el consumo de frijol goza de una larga tradición y gran demanda. Constituye uno de los granos fundamentales en la alimentación del pueblo, siendo un alimento de preferencia en la dieta diaria, al menos en una de las comidas. Su aceptable contenido de proteínas lo sitúan como un cultivo estratégico del país. Sin embargo, existe la necesidad de explotar todos los recursos posibles para incrementar los niveles de producción actuales si se quiere mantener los índices de consumo establecidos sin incrementar los niveles de importación, Urge entonces aumentar los rendimientos del cultivo, que según Chailloux et al.(1996), en América Latina se obtiene solo un 20 % de su rendimiento potencial, motivado por las deficiencias nutricionales unido a la incidencia de plagas y enfermedades, entre las que se destacan los hongos del suelo.
Las enfermedades en muchos lugares donde se cultiva el frijol son el factor principal en la reducción de los rendimientos. Entre los organismos causantes de enfermedades se encuentran los hongos fitopatógenos del suelo, existiendo en nuestro país de clima subtropical, condiciones favorables para el desarrollo y proliferación de los mismos.
Durante mucho tiempo se ha ido buscando solución a los problemas fitosanitarios de este cultivo con vistas a elevar su producción. Esto ha incitado a los productores introducirse en la búsqueda de vías sostenibles, que responda de forma eficiente en este empeño. Uno de los métodos que ha tomado auge se basa en la reducción de inóculos o la actividad del patógeno por la presencia natural de uno o más antagonista en la rizosfera (Willer y Kilcher, 2008).
Debido a que el control químico de estos fitopatógenos del suelo es costoso y, en algunos casos, infructuoso, el control cultural es difícil de aplicar y se carece de variedades resistentes, el presente trabajo tiene como objetivo evaluar el efecto de medios biológicos y productos naturales en la protección de plantas de frijol común frente al hongo S. rolfsii.
MATERIALES Y MÉTODOS
Los experimentos in vitro se desarrollaron en el Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias perteneciente a la Universidad Central “Marta Abreu” de Las Villas, Cuba. Se realizaron dos ensayos para evaluar el efecto antagónico de las rizobacterias B. subtilis, B. cepacia, P. fluorescens y P. aeruginosasobre el microorganismo fitopatógeno del suelo.
Cultivo Dual o Doble Capa:Se empleó el procedimiento descrito por Živković et al. (2010) con modificaciones menores, como se describe brevemente. Se utilizó Agar Nutriente en placas de Petri (9 cm de diámetro) las cuales fueron inoculadas con los diferentes microorganismos antagónicos en forma de zigzag, incubándose a 28˚C durante 24 horas. Posteriormente se adicionó una capa de agar papa (PDA) al 2 % y se colocó un disco de un cultivo puro de los hongos ensayados de 0,5 cm. de diámetro en el centro de la placa. Se realizaron evaluaciones desde 24 horas hasta 72 horas.
Método de los Pocillos: Se realizó según Megaldi (2004), revisado por Balouri et al. (2016), con pequeñas modificaciones. Las cepas bacterianas se activaron en 5 ml de caldo nutriente, las cuales se incubaron a 28 °C±1 por 48 horas. Luego en placas de Petri con medio agar nutriente se hicieron dos perforaciones con un perforador de tapones de 0,5 cm de diámetro en extremos opuestos de la placa. A éstos se les añadió 0,1 ml de suspensión bacteriana, seguidamente se colocó un disco de cada hongo estudiado de 0,5 cm de diámetro en el centro de la placa, incubándose a 28 °C±1 evaluándose el crecimiento en cm2, de 24 a 72 horas.
En ambos métodos se calculó la inhibición que ejerció cada una de las bacterias sobre los hongos estudiados mediante el porcentaje de inhibición del crecimiento radial (PICR) según Rahman et al., (2007). Como control se empleó agua desionizada estéril en lugar de la suspensión bacteriana. Para cada cepa bacteriana se emplearon tres réplicas.
PICR= ((R1-R2)/R1)∙100, Donde:
R1 – diámetro de crecimiento micelial del patógeno en ausencia de la bacteria.
R2 – diámetro de crecimiento micelial del patógeno en presencia de la bacteria.
En los experimentos en condiciones controladas y de campo se evaluó el efecto antagonista de cuatro bacterias (B. subtilis, B. cepacia, P. fluorescensyP. aeruginosa) y el hongo Trichoderma viride; así como el efecto protectante de los compuestos naturales quitosana en su formulación comercial Chitoplant® y Fungend. Se incluyó un control químico con el producto comercial Tetrametil Tiuram Disulfuro (TMTD 80% PH) sobre S. rolfsii y un control absoluto.
Para todos los ensayos se emplearon semillas de frijol blanco de la variedad comercial Chévere (BAT-482).
Los tratamientos empleados en ambas condiciones ex vitro son los siguientes:
Pseudomonas fluorescens(cepa CMR12) procedente del Laboratorio de Fitopatología de la Facultad de Agronomía y Ciencias Biológicas Aplicadas de la Universidad de Gent, Bélgica; con una concentración de5,6x109 UFC (Unidades Formadoras de Colonias);Pseudomonas aeruginosa (cepa 7NSK2) procedente del Laboratorio de Fitopatología de la Facultad de Agronomía y Ciencias Biológicas Aplicadas de la Universidad de Gent, Bélgica con una concentración de 1,7x108 UFC; Bacillus subtilis (cepa ATCC 6051) procedente del Laboratorio de Microbiología de la Universidad de Gent, Bélgica, con una concentración de 1,8x108 UFC; Trichoderma viride (cepa TS-85) procedente del Laboratorio de Microbiología Agrícola de la FCA con una concentración de 1,2x109 esporas; Burkholderia cepacia(cepaCCIBP556W) procedente del Laboratorio de Microbiología del Instituto de Biotecnología de las Plantas (IBP), con una concentración de 4,6x109 UFC; Chitoplant ® (Quitosana 99,9%) al 0,1%. El método de aplicación fue inmersión de las semillas durante 1 hora; Control químico Tetrametil Tiuram Disulfuro (TMTD 80% PH) a una dosis de 3 g/L, mediante inmersión de las semillas durante 10 minutos y un Control absoluto (sin aplicación).
La aplicación de todas las cepas microbianas fue mediante “peletización” de la semilla.
Para la reproducción de las de las bacterias se empleó medio líquido de caldo nutriente en el caso de B. subtilis y medio de cultivo King-B para el caso deP. fluorescenscon la siguiente composición: proteosa peptona (20 g/L), K2HPO4 (1,5 g/L), MgSO4 7H2O (1,5 g/L), glicerol (15,0 ml/L), agar (15 g/L) (Unno et al., 2005; Trujillo et al., 2007). Los medios de cultivos fueron esterilizados en autoclave vertical a 121 ºC y 1,2 kg cm-2 de presión por 15 minutos. Los microorganismos se mantuvieron en condiciones óptimas de crecimientos (28±1 ºC) durante 24 horas. Estos cultivos, previa evaluación de sus concentraciones (108 UFC·ml-1), fueron utilizados como soluciones para el tratamiento de las semillas.
Para la peletización con bacterias, éstas se activaron en 5 ml de caldo nutriente durante 48 h, posteriormente se multiplicaron en un Erlenmeyer con 100 ml de caldo nutriente, se colocaron en una zaranda orbital Gerhardt durante 24 h a 30 ºC, luego se inoculó zeolita para cargarla con bacterias y se secó al aire durante 48 h, se cubrió la semilla con la zeolita cargada utilizando almidón de yuca al 8 % como material adherente y se secó nuevamente al aire durante 48 h para ser sembradas.
Como organismo patógeno se trabajó con S. rolfsii, obtenidos del cepario depositado en el Laboratorio de Fitopatología de la Facultad de Ciencias Agropecuarias perteneciente a la Universidad Central “Marta Abreu” de Las Villas, el que fue sembrado en placas de Petri (9 cm) con PDA (papa dextrosa agar) y mantenidos a 28 ºC durante siete días (Kator et al., 2015). Para su multiplicación se transfirieron discos de 1 cm de diámetro a Erlenmeyers previamente esterilizados en autoclave a 120 ºC durante una hora, los cuales se incubaron durante 15 días a 28 ºC.
Los experimentos en condiciones semicontroladas se realizaron en la Estación Experimental Agrícola “Álvaro Barba Machado”, Santa Clara. Se utilizó un diseño en bloques al azar con tres repeticiones. Los resultados constituyen la media de dos experimentos. La siembra se realizó empleando una distancia de 0,45 m x 0,07 m. Las parcelas tenían cuatro surcos de 5 m lineales para un área de 6,75 m2. Se cuantificó la proporción de plantas sanas (ausencia de los síntomas típicos causados por el agente causal) en relación al total de plantas evaluadas en los tres surcos internos de cada parcela (n= 100) para cada uno de los tratamientos descritos previamente.
Las evaluaciones en condiciones de campo se realizaron en el Huerto “Mi jardín” de Agricultura Urbana, Santa Clara, Cuba. Para la protección de las semillas y la siembra se emplearon los procedimientos previamente descritos en condiciones semicontroladas. Las atenciones culturales se desarrollaron según instructivo técnico del Ministerio de Agricultura (MINAGRI, 2000). Se evaluó la proporción de plantas enfermas por el agente causal en relación al número total de plantas (n= 100) en los tratamientos previamente descritos.
Las evaluaciones consistieron en determinar el número de plantas sanas y enfermas según el agente causal y para ello se realizaron observaciones micromórficas en los laboratorios de Sanidad Vegetal de Ciego de Ávila y de Fitopatología de la Facultad de Ciencias Agropecuarias de la Universidad Central de Las Villas.
Rendimiento por tratamiento(g∙m2): Se calculó a partir de la media del rendimiento de tres parcelas por cada tratamiento.
Procesamiento estadístico.Se utilizaron pruebas paramétricas de comparación de medias (ANOVA, Tukey, p > 0.05) y pruebas no paramétricas (Kruskal-Wallis, Student-Newman-Keuls, p<0.05).
RESULTADOS Y DISCUSIÓN
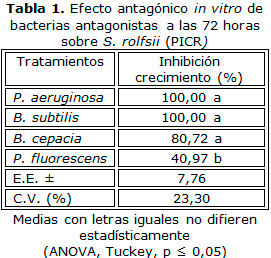
La Tabla 1 muestra el efecto de bacterias biocontroladoras en la inhibición del crecimiento de S. rolfsii durante 72 horas del cultivo dual. Como control se creció el aislado de S. rolfsii en las mismas condiciones descritas para el experimento, sin evidencias de inhibición de su crecimiento.Las cepas empleadas de P. aeruginosay B. subtilisinhibieron totalmente el crecimiento de S. rolfsii, aunque sin diferencias significativas con el efecto mostrado por la cepa de B. cepacia, la cual indujo niveles de inhibición del 72 %. Niveles de inhibición significativamente menores se lograron con P. fluorescens.
La Tabla 2 muestra el efecto antagónico de las rizobacterias evaluadas a través del método de los pocillos sobre el crecimiento de S. rolfsii. Como control se utilizó el aislado de S. rolfsii en las mismas condiciones descritas para el experimento, sin evidencias de inhibición de su crecimiento. Con este procedimiento de evaluación, ninguno de los tratamientos evaluados logró inhibir al 100 % el crecimiento del patógeno. Los mayores niveles de inhibición se lograron con el empleo de la cepa de P. aeruginosa, la cual se diferenció significativamente en su acción antagónica con relación a las otras tres especies evaluadas.
Hongos fitopatógenos como S. rolfsiihan sido controlados por bacterias antagonistas (Szczech y Shoda 2004). Kishore et al.(2005) evaluaron la actividad antifúngica de 393 cepas bacterianas frente a cinco hongos necrotróficos: Aspergillus flavus, Aspergillus niger, Rhizoctonia bataticola, Rhizoctonia solani y S. rolfsii; así como contra tres hongos biotróficos: Cercospora arachidicola, Phaeoisariopsis personata y Puccinia arachidis; los cualesobtuvieron los mejores resultados con Pseudomonas aeruginosa (cepa GSE 18), la que mostró una actividad antifúngica de amplio espectro.
Especies de Pseudomonas son capaces de producir diversos metabolitos secundarios con un amplio espectro de propiedades antifúngicas en condiciones de antagonismo in vitro. Por su parte, Mavrodi et al.(2006), señalan que las fenazinas incluyen alrededor de 50 metabolitos secundarios pigmentados que contienen átomos de nitrógeno heterocíclicos, los cuales son sintetizados por especies de Pseudomonasy otros géneros bacterianos. Las mismas poseen propiedades antibióticas, conocidas por más de 150 años, y propuestas como candidatos potenciales para el control biológico de hongos patógenos del suelo.
Villa et al.(2001) reportaron que Gluticid, un producto elaborado a partir de metabolitos de una cepa Pseudomonas aeruginosa, disminuyó en un 100 % el crecimiento in vitro de Curvularia gudauskasii, C. senegalensis, C. trifolii y Dreschlera spicifera, aislados de la semilla botánica de la caña de azúcar, variedades Ja 64-19 y B6368.
Al analizar el efecto antagónico in vitro de bacterias biocontroladoras se obtuvieron los mejores resultados con el método de la doble capa, con respecto al método de los pocillos. En el método de la doble capa el hongo a evaluar se encuentra en un medio donde la bacteria está previamente establecida en la placa, a diferencia del método de difusión en agar (pocillos) donde los dos se inoculan simultáneamente. De este modo, es de esperar que el biocontrol con el empleo de estas bacterias antagonistas sea más efectivo en su acción preventiva.
El efecto del tratamiento a la semilla con organismos antagonistas y sustancias naturales sobre las afectaciones por S. rolfsii en condiciones semicontroladas se muestra en la Figura 1. Los mejores resultados se obtuvieron con los tratamientos de P. fluorescens, P. aeruginosa y B. subtilis; los resultados fueron similares estadísticamente a los logrados con el control químico (TMTD 80 % PH). Estos tres tratamientos resultaron significativamente superiores al control, a B. cepaea y a los productos naturales evaluados en la reducción de la proporción de plantas enfermas, los cuales no difirieron entre sí.
Gupta et al.(2006) utilizaron la cepa GRC de Pseudomonas aeruginosa en la bacterización de semillas de maní, con lo cual lograron mayores porcentajes de germinación y sobrevivencia, así como una reducida incidencia de Sclerotium sclerotiorum.
Bajo las condiciones de campo evaluadas,S. rolfsii y Rhizoctonia solani fueron las especies fitopatógenas que incidieron sobre el cultivo del frijol, en un suelo Pardo mullido sin carbonatos.
Las mayores afectaciones fueron causadas por S. rolfsii, con proporción de 0,62 plantas afectadas del total de plantas evaluadas en el tratamiento control. Sin embargo, todos los tratamientos biológicos y de productos naturales ensayados controlaron este patógeno (Figura 2). No se encontraron diferencias significativas en los tratamientos con las bacterias antagonistas, Trichoderma viride (cepa TS-85) y el compuesto natural Chitoplant ®.
Los tratamientos con las especies de Pseudomonasevaluadas evidencian el efecto antifúngico contra el fitopatógeno del suelo S. rolfsii. Laha et al.(1996) aseveran que las bacterias antagonistas del género Pseudomonas se encuentran entre los agentes de control microbiológico más promisorios, mientras que Doñaz et al.(2003) demostraron que esta bacteria tiene una actividad antagónica frente a un espectro amplio de hongos patógenos del suelo y una alta capacidad de biocontrol.
Por su parte, Montealegre (2005) hace referencia al uso de B. subtilis en el control de Botrytis cinerea.González y Fragoso (2002) señalaron que esta bacteria no es potencialmente patógena, no produce endotoxinas y secreta proteínas al medio, algunas de ellas con propiedades antifúngicas como la subtilina y otros antibióticos que son polipéptidos que actúan sobre la pared celular de los hongos. La subtilina liberada por Bacillus subtilis actúa sobre la pared celular del hongo por su antagonismo, logrado a través de diversos mecanismos que incluyen la competencia por nutrientes, exclusión de sitios o la liberación de compuestos celulares durante el crecimiento, con el objetivo de eliminar o reducir los competidores en su medio ambiente inmediato (Butt et al. 1999).
Silva et al.(2004) evaluaron el potencial fungicida de la quitosana a diferentes concentraciones frente al desarrollo in vitro de cepas de Colletotrichum gloeosporioidesy demostraron que a mayor concentración de quitosana hubo un mayor efecto fungicida. También evaluaron el efecto inhibidor de la Quitosana y extractos acuosos de plantas sobre el crecimiento de Fusarium oxysporium, Penicillium digitatumyRhizopus stolonifer,con excepción de la esporulación de Penicillum digitatum, la quitosana inhibió el crecimiento micelial y la esporulación en comparación con los extractos de plantas. La quitosana acelera la degradación de las paredes celulares de hongos que poseen quitina en su composición.
Al evaluar los rendimientos obtenidos en las condiciones de campo ensayadas (Figura 3), los mayores rendimientos se obtuvieron con P. fluorescens,P. aeruginosa, B. subtilis y T. viride,sin diferencias estadísticas con B. cepacia. Los menores rendimientos se obtuvieron en el control sin protección, con diferencias estadísticas significativas con todos los tratamientos.
CONCLUSIONES
En todos los ensayos los tratamientos con bacterias antagonistas fueron superiores a sus respectivos controles absolutos en cuanto a la disminución del número de plantas muertas por S. rolfsii. En algunos casos las bacterias y los productos naturales tuvieron un efecto similar al del control químico con TMTD.
BIBLIOGRAFÍA
BALOUIRI, M., S. MOULAY, S. IBNSOUDA. Methods for in vitro evaluating antimicrobial activity: A review. En: Journal of Pharmaceutical Analysis. 6:71–79, 2016.
BUTT, T.M., J.G. RAIZ, K.A. POWELL. Microbial biopesticides. The European scene. En: Hill, F. R. and Menn, J. J. (Eds.). Biopesticides,. Use and delivery. Humana Press. 23-24, 1999.
CHAILLOUX, M., G. HERNÁNDEZ, B. FAURE, R. CABALLERO. Producción de frijol en Cuba: Situación actual y perspectiva inmediata. En: Agronomía mesoamericana, 7 (2): 98-107, 1996.
DOÑAZ, R., F.M. CAZORLA, G.V. BLOEMBERG y A. PÉREZ. Un compuesto antifúngico producido por Pseudomonas fluorescensPCL1606 está implicado en el biocontrol frente a la podredumbre radicular del aguacate. Congreso Mundial del Aguacate. 84-85, 2003.
GONZÁLEZ, V. y S. FRAGOSO. Bacillus subtilis. 2002. Disponible en: htpp://www.2.cbm.uam.es.html Consultado el 15 de mayo del 2006.
GUPTA, C.P., B. KUMAR, R.C. DUBEY y D.K. MAHESHWARI. Chitinasemediated destructive antagonistic potential of Pseudomonas aeruginosaGRC1 against Sclerotinia sclerotiorumcausing stem rot of peanut. En: BioControl. 51 (6): 821-835, 2006.
KATOR, L., Z.Y. HOSEA, O.D. OCHE. Sclerotium rolfsii; causative organism of southern blight, stem rot, white mold and sclerotia rot disease. En: Annals of Biological Research, 6 (11): 78-89, 2015.
KISHORE, G.K., S. PANDE, A.R. PODILE. Biological control of collar rot disease with broad-spectrum antifungal bacteria associated with groundnut. En: Canadian Journal of Microbiology. 51 (2): 123-132, 2005.
LAHA, G.S., R.P. SINGH y J.P. VERNA. Role of growth promoting Plants. Cerials, Pulses, Oildseeds and crops. En: Int'I Book and Periodical, New Delhi, India, 2: 233-241, 1996.
MAGALDI, S., S. MATA-ESSAYAG, C. HARTUNGDE-CAPRILES. Well diffusion for antifungal susceptibility testing. En: Int. J. Infect.Dis. 8: 39–45, 2004.
MARTÍNEZ, L., R. BERNSTEN, M. ZAMORA. Estrategias de mercado para el frijol Centroamericano. En: Agronomía Mesoamericana, 2 (15): 121-130, 2004.
MAVRODI, D., W. BLANKENFELDT, L. THOMASHOW. Phenazine. Compounds in Fluorescent Pseudomonasspp. Biosynthesis and Regulation. En: Annual Review of Phytopathology. 44: 417-445, 2006.
MINAGRI. Guía técnica para el cultivo de frijol en Cuba. Instituto de Investigaciones Hortícolas "Liliana Dimitrova", La Habana, Cuba. 2000, 40 p.
MONTEALEGRE, A. J. R. Perspectivas y situación del uso de Biofungicidas en Chile. Facultad de Ciencias Agronómicas, Universidad de Chile, Santiago de Chile, Chile. 2005.
SILVA, L., L. CIAMPI, R. FUENTES, R. SCHOBITZ. Evaluación de biocapsulas bajo condiciones de campo para el control de Rhizoctonia solani AG-3 en papa. 2004. Disponible en: http://alerce.inia.cl Consultado el 2 de enero de 2009.
SVETLANA, Ž., S. STOJANOVIĆ, Ž. IVANOVIĆ, V. GAVRILOVIĆ, T. POPOVIĆ and J. BALAŽ. Screening of antagonistic activity of microorganisms against Colletotrichum acutatum and Colletotrichum gloeosporioides. En: Arch. Biol. Sci., Belgrade, 62 (3), 611-623, 2010.
SZCZECH, M. y M. SHODA. Biocontrol of Rhizoctonia Damping-off of Tomato by Bacillus subtilis combined with Burkholderia cepacia. En: Journal of Phytopathology. 152 (10): 549-556, 2004.
TRUJILLO, I., A. DÍAZ, A. HERNÁNDEZ, M. HEYDRICH. Antagonismo de cepas de Pseudomonas fluorescens y Burkholderia cepacia contra hongos fitopatógenos del arroz y el maíz. En: Rev. Protección Veg., 22 (1): 41-46, 2007.
UNNO, Y., K. OKUBO, J. WASAKI, T. SHINANO, M. OSAKI. Plant growth promotion abilities and microscale bacterial dynamics in the rhizosphere of Lupin analysed by phytate utilization ability. En: Env. Microb. 7(3): 396-404, 2005.
VILLA, P., M.E. DÍAZ DE VILLEGAS, M. STEFANOVA y G. MICHELENA. Proceso biotecnológico para la producción de un fungicida a partir de Pseudomonas sp.Cepa PSS, con fines fitosanitarios. En: Innovación de Tecnologías Ecológicas para el Agro. 65-74, 2001.
WILLER, H. and L. KILCHER. The World of Organic Agriculture. Statistics and Emerging Trends, IFOAM, Bonn, and FiBL. 2008, 183 p.
Recibido: 16/03/2016
Aceptado: 03/06/2016