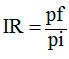
ARTÍCULO DE INVESTIGACIÓN
Efecto de nematicidas biológicos y del portainjerto en la producción de sandía (Citrullus lanatus L.) en Ecuador
Effect of biological nematicides and the rootstock on watermelon (Citrullus lanatus L.) production in Ecuador
Néstor Orrala Borbor1, Lidcay Herrera Isla2, Mercedes Arzube Mayorga1, Livington Pozo Pozo1
1-
Centro de Investigaciones Agropecuarias, Universidad Estatal Península
de Santa Elena. Ecuador. Vía principal Santa Elena- La Libertad. CP 241702.
2- Universidad Central Marta Abreu de Las Villas. Villa Clara. Cuba. Carretera
a Camajuani km. 5,5, Santa Clara, Villa Clara, Cuba. CP 54 830.
E-mail:norrala@upse.edu.ec;
norralab@hotmail.com
RESUMEN
Los nematodos constituyen una importante plaga agrícola para la sandía y dentro de ellos las especies Meloidogyne incognita (Kofoid y White) Chitwood y Rotylenchulus reniformis Lindford y Oliveira. El empleo de portainjertos constituye una práctica muy eficaz para controlar patógenos del suelo incluyendo los nematodos, y esta investigación se realizó con el objetivo de evaluar el efecto de diferentes nematicidas de origen biológico y químico en un diseño de bloques al azar con tres réplicas. Se utilizó el híbrido de sandía Royal Charleston injertado sobre RS-841 (Cucurbita maxima x Cucurbita moschata). Las dosis empleadas fueron las recomendadas por el fabricante, aplicadas al suelo al trasplante y a los 20 días con suelo en capacidad de campo. A los 45 días después del trasplante y después de la primera cosecha (65 ddt), se determinó el Índice de Agallamiento (IA), el Factor de Reproducción (FR) e Índice de Reproducción (IR). Se evaluaron en cada variante las variables agronómicas y de calidad del fruto. Los resultados arrojaron que los nematicidas aplicados no controlaron el ataque de M. incognita ni de R. reniformis hasta los 45 días después del trasplante, pero el injerto sobre el patrón de calabaza RS 841, aun con niveles de agallamientos muy altos, debido al desarrollo y vigor de las plantas, permiten obtener producción comercial satisfactoria.
Palabras clave: Meloidogyne incognita, Rotylenchulus reniformis, sandía, nematicidas, injerto
ABSTRACT
The nematodes are the important pests for watermelon and among them Meloidogyne incognita (Kofoid y White) Chitwood and Rotylenchullus reniformis Linford and Oliveira. The use of rootstock is a power tool to control soil borne diseases like nematodes, and this research had as main objective to evaluate the effect of several bionematocides and chemicals in a randomized block design with three replications. The watermelon hybrid Royal Charleston grafted on RS-841 (Cucurbita maxima x Cucurbita moshata), was planted. The dosages employed were the recommend by the fabricant and were applied to soil in two moments, at transplant and 20 days after. The galling index (AI), the reproduction factor (FR) and reproductive index (IR) were determined 45 days after transplantation and after the first harvest (65 d). The evaluation consisted in determine agronomicals parameters and fruit quality. The results showed that applied nematicides no controlling M. incognita nor R. reniformis before 45 days after transplantation, but the grafted plants with high gall levels because the important development and vigor of the plant, allow to obtain satisfactory commercial yield.
Keywords: Meloidogyne incognita, Rotylenchulus reniformis, watermelon, nematocides, graft
INTRODUCCIÓN
La sandía representa el 46 % de las cucurbitáceas cultivadas en el mundo (Magrama, 2013); se estima que las pérdidas anuales por efecto de nematodos están en el orden del 8,8-14,6 % del total de los cultivos producidos y equivalen a 157 mil millones de dólares (Nicol et al., 2011).
Según Salazar-Antón y Guzmán-Hernández (2013), el principal nematodo que ataca a la sandía es Meloidogyne incognita (Kofoid y White) Chitwood; aunque también se reportan poblaciones altas de Rotylenchulus reniformis Linford y Oliveira (15.000 especímenes por 100 cm-3 de suelo) en campos de melón de Brasil.
En Ecuador, la sandía es un rubro agrícola importante en el trópico seco del litoral ecuatoriano, específicamente en la provincia de Santa Elena donde pequeños y medianos productores siembran cada año alrededor de 750 ha con una producción de 22 500 t, generando 4 500 000 dólares a nivel de finca (Ministerio de la Producción, 2011); sin embargo, en los últimos años el rendimiento por unidad de superficie y calidad de fruto se ven afectados por hongos del suelo y nematodos.
El
injerto de cultivares locales de sandía sobre los portainjertos introducidos,
soluciona problemas de enfermedades y nematodos del suelo (Lee et al., 2010);
permite cultivar variedades en las cuales no se ha conseguido introducir resistencias
de enfermedades, así como soportar bajas temperaturas, salinidad y asfixia
radical (Martínez-Ballesta et al., 2010), por lo que la investigación
persiguió evaluar el efecto de nematicidas de origen biológico
en la producción y calidad del fruto de sandía injertada sobre
la calabaza.
MATERIALES
Y MÉTODOS
El estudio se ejecutó en la Granja Zoilita, municipio de Santa Elena, Ecuador y en el laboratorio del Centro de Investigaciones Agropecuarias (CIAP) de la Universidad Estatal Península de Santa Elena, de octubre 2013 a febrero 2014; de mayo a diciembre presenta temperaturas promedio de 24 ºC y de enero a abril, 27,2 ºC; humedad relativa entre 74 y 82 % y precipitación anual en milimetros de 100 a 250.
Suelo de textura franca; materia orgánica, baja; fósforo, alto; potasio 551 µg ml-1, alto; conductibilidad eléctrica, 3,57 mS cm-1. En los suelos de la granja se siembra sandía desde 1984, dejando en barbecho cada año de mayo a octubre. Agua de riego, CE 1,833 dS m-1 y pH 8,4. Sistema de riego, por goteo, con líneas dispuestas cada cuatro metros, orientados Norte-Sur; goteros autocompensados, caudal 1,6 l h-1.
Para el estudio se evaluaron seis compuestos biológicos, cuyos componentes presentan efecto nematicida y han sido estudiados por numerosos autores (Schenck, 2004; Westphal et al., 2008; Jafri et al., 2015), más un tratamiento químico y un control absoluto (sin tratamiento) (Tabla 1) dispuestos en bloques al azar con tres réplicas; las dosis empleadas fueron las recomendadas por el fabricante, aplicadas al suelo al trasplante y a los 20 días con suelo en capacidad de campo. Híbrido de sandía utilizado, Royal Charleston de mayor aceptación en el mercado ecuatoriano injertado por aproximación (Oda, 1995) sobre RS-841 (Cucurbita maxima x Cucurbita moshata); densidad de siembra, 4166 plantas por hectárea. Como control se consideró el Control donde no se aplicó ningún tratamiento.
En
el laboratorio se determinó la población de juveniles infectivos
(J2) de M. incognita según metodología de Hussey y Barker (1973)
y para R. reniformis, de acuerdo con Shurtleff y Averre (2000).
El índice de agallamiento (IA) para Meloidogyne se estableció
mediante la escala 0 – 5 de Taylor y Sasser (1978); como Población
inicial Pi se tomó el valor de nematodos existentes en el suelo antes
de la implementación de los experimentos y como Población final
(Pf), el número de huevos y J2 a los 45 días y después
de la primera cosecha. Con este valor se calculó el Factor de reproducción
(FR) mediante la fórmula que permite medir la capacidad reproductiva
de M. incognita y R. reniformis (Ecuación 1):
Se determinó también el Índice de Reproducción (Ecuación 2):
donde,
P trat - número
de huevos-J2 producido por los tratamientos en estudio
P test - número de huevos-J2 producido por el control donde no se aplicó
ningún nematicida
La influencia de las poblaciones de nematodos sobre las variables agronómicas y de calidad de fruto (diámetro tallo, frutos por planta, peso del fruto, rendimiento agrícola, grados Brix, espesor de la corteza y dureza) fueron procesadas en el paquete estadístico INFOSTAT versión profesional para Windows y las medias comparadas según Tukey (p 0,05).
RESULTADOS Y DISCUSIÓN
Los resultados demuestran que todos los nematicidas empleados no impidieron el desarrollo de M. incognita (Tabla 2); en el suelo su población se incrementó entre 4,6 y 2433,3 veces a los 45 días del trasplante; posteriormente su población decrece y a los 65 días, oscila entre 0,1 en Neem X y 31 en el tratamiento Control. De igual forma es notorio el incremento de la población de R. reniformis a los 45 días para disminuir después de la primera cosecha.
En la raíz, el crecimiento de la población de M. incognita y de R. reniformis es menos elevado que en el suelo (Tabla 3) a la primera cosecha (65 ddt). Gómez et al. (2012) confirmaron que el IA no es el único elemento para determinar, en este caso, el efecto de los nematicidas de origen biológico sobre los nematodos, por lo tanto, se puede tener bajos IA, pero altos niveles poblacionales.
En los parámetros de calidad (Tabla 4) y de producción (frutos/planta, peso fruto, rendimiento agrícola) no se observaron diferencias significativas, confirmando lo obtenido por Orrala (2013) en las condiciones agroecológicas de Santa Elena, Ecuador. Otros investigadores (López-Elías et al., 2010; Álvarez-Hernández et al., 2013) en diferentes regiones del mundo, al utilizar patrones interespecíficos de Cucurbita maxima x Cucurbita moschata obtuvieron valores similares a la presente investigación. Baixauli et al. (2013) indican que con el portainjerto RS 841, aún con niveles de agallamientos muy altos, debido al desarrollo y vigor de las plantas, se obtiene producción comercial satisfactoria.
En cuanto al efecto de los nematicidas de origen biológico sobre las variables de producción (DongHai et al., 2011; Jaramillo-Pineda, 2014 y Jafri et al., 2015) reportan propiedades nematicidas del género Bacillus, aunque Fernández-Larrea (2002) menciona su poca persistencia en el campo.
En
las pruebas de invernadero, los hongos micorrízicos no suprimieron la
incidencia de M. incognita, mejoró el establecimiento temprano de la
planta, pero no aumentó el rendimiento agrícola (Westphal et al.,
2008); se ha demostrado también que P. lilacinus es un parásito
facultativo de huevos de nematodos y en ocasiones es capaz de infectar estados
móviles o sedentarios, requiere altas temperaturas del suelo; su efectividad
ha sido comprobada en varios estudios (Schenck, 2004).
CONCLUSIONES
Los
resultados permiten concluir que el uso de portainjerto tolerantes es una alternativa
para obtener rendimientos satisfactorios a pesar de la presencia de altas poblaciones
de M. incognita y de R. reniformis.
BIBLIOGRAFÍA
1. ÁLVAREZ-HERNÁNDEZ, J.C., J.Z. CASTELLANOS-RAMOS, F. CAMACHO-FERRE, C.L. AGUIRRE-MANCILLA, J.A. RANGEL-LUCIO y M.V. HUITRÓN-RAMÍREZ. Comportamiento de la sandía injertada expuesta a suelos con problemas fitosanitarios y densidades de población. Congreso Nacional de Ciencia y tecnología Agropecuaria. Sociedad Mexicana de Ciencia y Tecnología Agropecuaria, A. C. e Instituto Tecnológco de Roque, Guanajuato, Mexico. 2013, 265-272.
2. BAIXAULI, C., A. GINER, J.M. AGUILAR, I. NÁJERA y A. NÚÑEZ. Estudio del comportamiento de diferentes portainjertos en un cultivo de sandía sin pepitas. VII Congreso Ibérico de Agroingeniería y Ciencias Hortícolas. Madrid, España, 26 - 29 de Agosto, 2013.
3. DONGHAI, P., LUJUN, C., FENSHAN, W., FENGJUAN, Z., LIFANG, R. y MING, S. Synergistic activity between B. thuringiensis Cry6Aa and Cry55Aa toxins against Meloidogyne incognita. M. Biotechnology, 4(6): 794-798, 2011.
4. FERNÁNDEZ-LARREA, O. Tecnologías de producción de Bacillus thuringiensis. Manejo Integrado de Plagas y Agroecología, 64: 110-115, 2002.
5. GÓMEZ, L., R. ENRIQUE, M.I. HERNÁNDEZ-OCHANDÍA, E. GONZÁLEZ, B. PETEIRALL y M.G. RODRÍGUEZ. Susceptibilidad de genotipos de Solanum lycopersicum L. frente a Meloidogyne incognita Kofoi y White (Chitwood). Rev. Protección Vegetal, 27 (2): 111-116, 2012.
6. HUSSEY, R. y K. BARKER. A comparison of methods of collecting inocula of Meloidogyne spp., including a new tecnic. Plant Disease Reporter, 57 (12): 1025-1029, 1973.
7. JAFRI, I., A. SHAHID, A. IBRAHIM y M. ATIF. Efficacy of different bacterial strains against Meloidogyne incognita. Pakistan Jounal of Nematology, 33 (1): 39-46. 2015.
8. JARAMILLO-PINEDA, J. Evaluación de la actividad nematicida de cepas nativas y de colección de Bacillus thuringiensis contra el nematodo formador de nódulos de la raíz (Meloidogyne incognita). Tesis de Doctorado. Universidad Autonóma de Nuevo León, Monterrey, México. 2014, 66 p.
9. LEE, J.M., C. KUBOTA, S. TSAO, Z. BIE, P. HOYOS-ECHEVERRÍA, L. MORRA y M. ODA. Current staus of vegetable grafting: difusión, grafting techniques, automation. Scientia Horticulture, 127: 93-105, 2010.
10. LÓPEZ-ELÍAS, J., F. PACHECO-AYALA, M.A. HUEZ-LÓPEZ, J.C. RODRÍGUEZ, J. JIMÉNEZ-LEÓN y S. GARZA-ORTEGA. Sandía (Citrullus lanatus (Thunb.) Matsun. y Nakai) injertada sobre diferentes portainjertos de calabaza (Cucurbita maxima x Cucurbita moshata). Biotecnia, 12 (2): 3-10, 2010.
11. MAGRAMA. Anuario de Estadística. Superficies y producciones de cultivos: sandía. España: Ministerio de Agricultura, Alimentación y Medio Ambiente. 2013. En sitio web: http://www.magrama.gob.es/es/estadistica/temas/publicaciones/anuario-deestadística/2012 Consultado el 20 de enero de 2016.
12. MARTÍNEZ-BALLESTA, M., C. ALCARAZ-LÓPEZ, B. MURIES, C. MOTA-CÁRDENAS y M. CARVAJAL. Physiological aspects of rootstock-scion interactions. Scientia Horticulturae, 127 (2): 112-118, 2010.
13. MINISTERIO DE LA PRODUCCIÓN. Agendas para la transformación productiva territorial: Santa Elena. 2011. En sitio web: http://www.producción.gob.ec/.../Agenda_Territorial-Santa Elena Consultado el 12 de Abril de 2016.
14. NICOL, J.M., S.J. TURNER, D.L. COYNE, L. NIJS, S. HOCKLAND y Z. TAHNA-MAAFI. Current nematode threats world agriculture. En J. JONES, G. GHEYSEN y C. FENOLL (Edits.). Genomics and molecular genetics of plant-nematode interaction. Turkey: Springer. 2011, 557 p. ISBN: 978-94-007-0433-6. DOI: 10.1007/978-94-007-0434-3
15. ODA, M. New grafting methods for fruit-bearing vegetables in Japan. Jpn. A.R.Q., 29 (3): 187-194, 1995.
16. ORRALA, N. Influencia de patrones sobre la producción y calidad del fruto de sandía en Santa Elena, Ecuador. Centro Agrícola, 40 (4): 5-11, 2013.
17. SALAZAR-ANTÓN, W. y T.D. GUZMÁN-HERNÁNDEZ. Efecto de poblaciones de Meloidogyne sp. en el desarrollo y rendimiento del tomate. Agronomía Mesoamericana, 241 (2): 419-426, 2013.
18. SCHENCK, S. Control of nematode in tomato with Paecilomyces lilacinus Strain 251. Vegetable Report, 5: 1-5, 2004.
19. SHURTLEFF, M. y C. AVERRE. Diagnosing plant disease caused by nematodes. The American Phytopathological Society (APS). 2000, 189 p. ISBN: 978-0-89054-254-5.
20. TAYLOR, A.
y J. SASSER. Experimental and agronomic use of nematicides. Depto. of Plant
Pathology, North Carolina State University, USA. 1978, 20 p.
Recibido:
06/06/2016
Aceptado: 08/09/2016